Слайд 2
Ге́лий — второй порядковый элемент периодической системы химических
элементов Д. И. Менделеева, с атомным номером 2. Расположен
в главной подгруппе восьмой группы. Возглавляет группу инертных газов в периодической таблице. Простое вещество гелий— инертный одноатомный газ без цвета, вкуса и запаха.
Гелий — один из наиболее распространённых элементов во Вселенной, он занимает второе место после водорода. Также гелий является вторым по лёгкости (после водорода) химическим элементом.
Гелий добывается из природного газа процессом низкотемпературного разделения.
Слайд 3
История открытия:
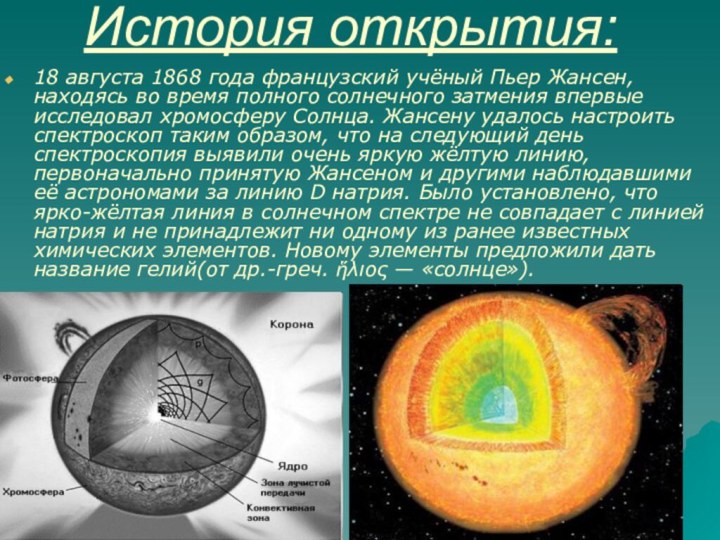
18 августа 1868 года французский учёный Пьер
Жансен, находясь во время полного солнечного затмения впервые исследовал
хромосферу Солнца. Жансену удалось настроить спектроскоп таким образом, что на следующий день спектроскопия выявили очень яркую жёлтую линию, первоначально принятую Жансеном и другими наблюдавшими её астрономами за линию D натрия. Было установлено, что ярко-жёлтая линия в солнечном спектре не совпадает с линией натрия и не принадлежит ни одному из ранее известных химических элементов. Новому элементы предложили дать название гелий(от др.-греч. ἥλιος — «солнце»).
Слайд 4
Только через 27 лет после своего первоначального открытия
гелий был обнаружен на Земле — в 1895 году
шотландский химик Уильям Рамзай, исследуя образец газа, полученного при разложении минерала клевеита, обнаружил в его спектре ту же ярко-жёлтую линию, найденную ранее в солнечном спектре.
В 1896 году Генрих Кайзер, Зигберт Фридлендер, а еще через два года Эдвард Бэли окончательно доказали присутствие гелия в атмосфере.
Слайд 5
Распространённость Во Вселенной :
Гелий занимает второе место по
распространённости во Вселенной после водорода — около 23 %
по массе. Однако на Земле гелий редок. Практически весь гелий Вселенной образовался в первые несколько минут после Большого Взрыва, во время первичного нуклеосинтеза.
В современной Вселенной почти весь новый гелий образуется в результате термоядерного синтеза из водорода в недрах звёзд. На Земле он образуется в результате альфа-распада тяжёлых элементов это ядра гелия-4).
Часть гелия, возникшего при альфа-распаде и просачивающегося сквозь породы земной коры, захватывается природным газом, концентрация гелия в котором может достигать 7 % от объёма и выше.
Слайд 6
Физические свойства:
Гелий — практически инертный химический элемент.
Простое вещество
гелий — нетоксично, не имеет цвета, запаха и вкуса.
При нормальных условиях представляет собой одноатомный газ. Его точка кипения (T = 4,215 K для 4He) наименьшая среди всех простых веществ; твёрдый гелий получен лишь при давлениях выше 25 атмосфер — при атмосферном давлении он не переходит в твёрдую фазу даже при крайне близких к абсолютному нулю температурах. Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при нормальных условиях.
Слайд 7
Свойства в газовой фазе:
При нормальных условиях гелий ведёт
себя практически как идеальный газ. Фактически при всех условиях
гелий моноатомный. Он обладает большей теплопроводностью , чем у других газов, кроме водорода, и его удельная теплоёмкость чрезвычайно высока.
При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску. По мере уменьшения давления происходит смена цветов — розового, оранжевого, жёлтого, ярко-жёлтого, жёлто-зелёного и зелёного. Это связано с присутствием в спектре гелия нескольких серий линий, расположенных в диапазоне между инфракрасной и ультрафиолетовой частями спектра. В результате увеличения длины свободного пробега электрона происходит смещение спектральных линий от инфракрасного к ультрафиолетовому краю.
Слайд 8
Символ элемента, выполненный из газоразрядных трубок, наполненных гелием:
Слайд 9
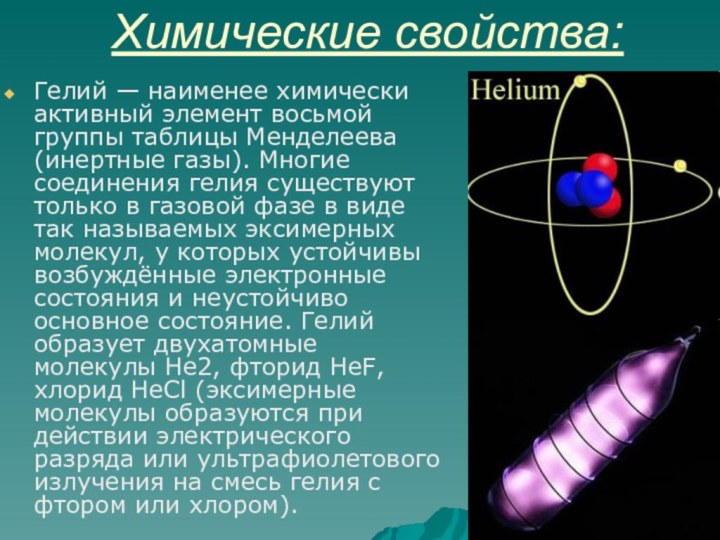
Химические свойства:
Гелий — наименее химически активный элемент восьмой
группы таблицы Менделеева (инертные газы). Многие соединения гелия существуют
только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние. Гелий образует двухатомные молекулы He2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или ультрафиолетового излучения на смесь гелия с фтором или хлором).
Слайд 10
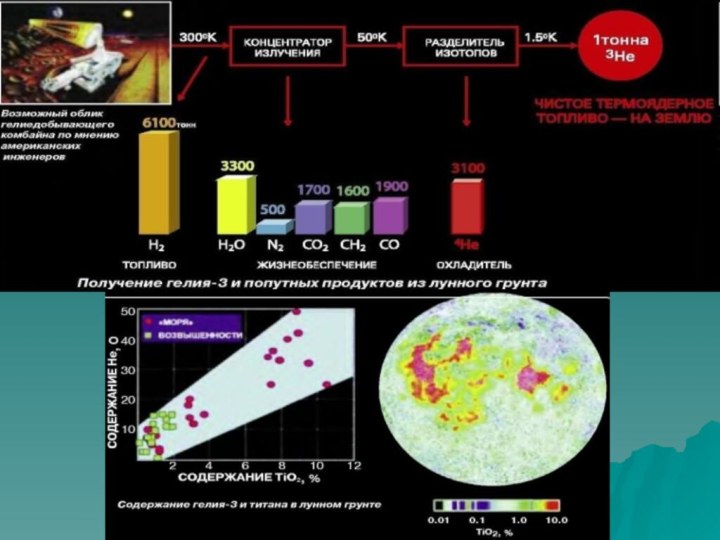
Получение:
В промышленности гелий получают из гелийсодержащих природных газов

(в настоящее время эксплуатируются главным образом месторождения, содержащие >
0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов. Охлаждение производят дросселированием в несколько стадий очищая его от CO2 и углеводородов. В результате получается смесь гелия, неона и водорода. Эту смесь очищают от водорода с помощью CuO. Окончательная очистка достигается охлаждением оставшейся смеси кипящим под вакуумом N2 и адсорбцией примесей на активном угле в адсорберах, также охлаждаемых жидким N2. Производят гелий технической чистоты (99,80 % по объёму гелий) и высокой чистоты (99,985 %).
По производству гелия лидируют США (140 млн м³ в год), затем — Алжир (16 млн м³). Россия занимает третье место в мире — 6 млн м³ в год. Мировые запасы гелия составляют 45,6 млрд м³. Крупные месторождения находятся в США (45 % от мировых ресурсов), далее идут Россия (32 %), Алжир (7 %), Канада (7 %) и Китай (4 %)
Слайд 12
Для транспортировки газообразного гелия используются стальные баллоны (ГОСТ
949-73) коричневого цвета, помещаемые в специализированные контейнеры. Для перевозки
можно использовать все виды транспорта при соблюдении соответствующих правил перевозки газов.
Для перевозки жидкого гелия применяются специальные транспортные сосуды светло-серого цвета объёмом 10, 25 и 40 литров, соответственно. При выполнении определённых правил транспортировки может использоваться железнодорожный, автомобильный и другие виды транспорта. Сосуды с жидким гелием обязательно должны храниться в вертикальном положении.
Транспортировка: