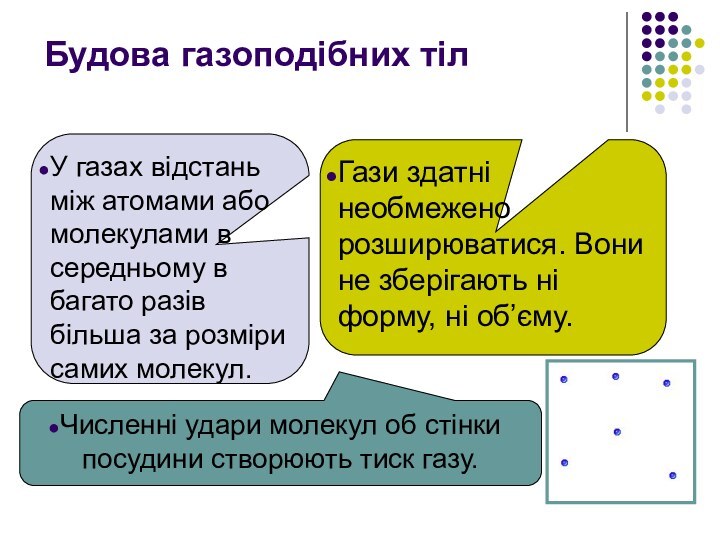
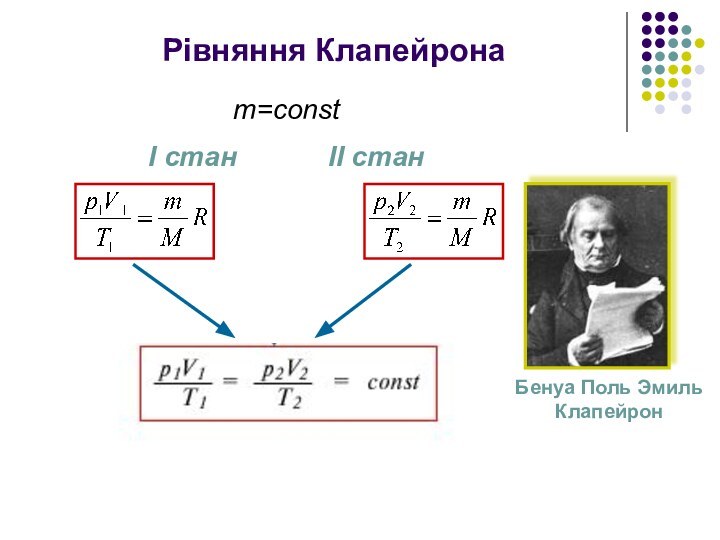
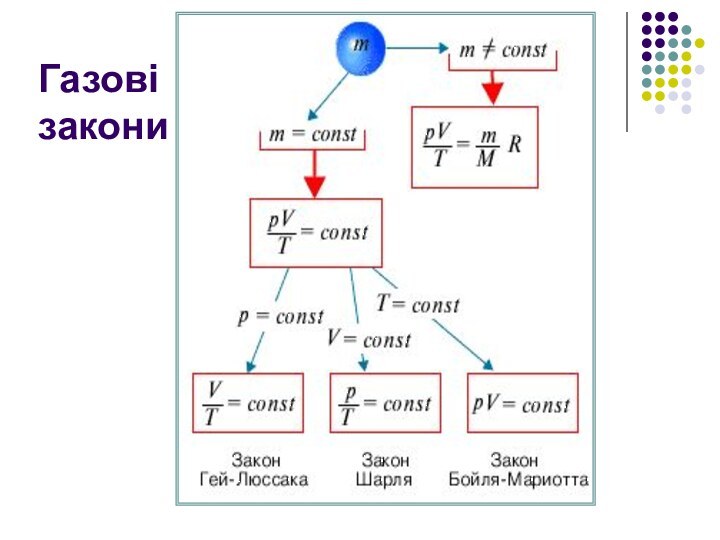
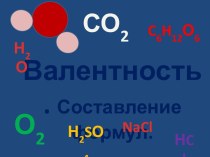
з найдрібніших частинок – молекул чи атомів.
Атоми і молекули
перебувають у безперервному хаотичному (тепловому) русі.Між молекулами (атомами) існують сили взаємодії, які залежать від відстані між ними і можуть бути силами притягання і відштовхування.