- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Карбоновые кислоты
Содержание
- 2. План:Способы получения карбоновых кислот. Строение карбоксильной группы
- 3. Карбоновые кислоты-это органические соединения, молекулы которых содержат
- 4. Карбоксильная группа относится к сложным функциональным группам,
- 5. С другой стороны, подача электронной плотности
- 6. По номенклатуре ИЮПАК (по международной номенклатуре) карбоновые
- 7. По рациональной номенклатуре карбоновые кислоты являются
- 9. Дикарбоновые кислотыНООС – СООН
- 10. Ароматические кислоты
- 11. Способы получения: 1) Гидролиз сложных эфиров:
- 12. 3 ) Гидролиз нитрилов
- 13. 5)Получение с помощью реактива Гриньяра и СО2
- 14. 8) Непредельные кислоты получают:
- 15. Физические свойства:Карбоновые кислоты до С3 – легкоподвижные
- 16. Химические свойства карбоновых кислот зависят от электронного
- 17. Благодаря этому электронному эффекту связь между атомом
- 18. По теории Бренстеда- Лоури карбоновые кислоты
- 19. Карбоновые кислоты по своему электронному строению
- 20. 1) Кислотные свойства проявляются в образовании солей
- 22. 3) Получение ангидридов с органическими и неорганическими
- 23. 4) Получение галогенангидридов:
- 24. 5) Получение амидов.
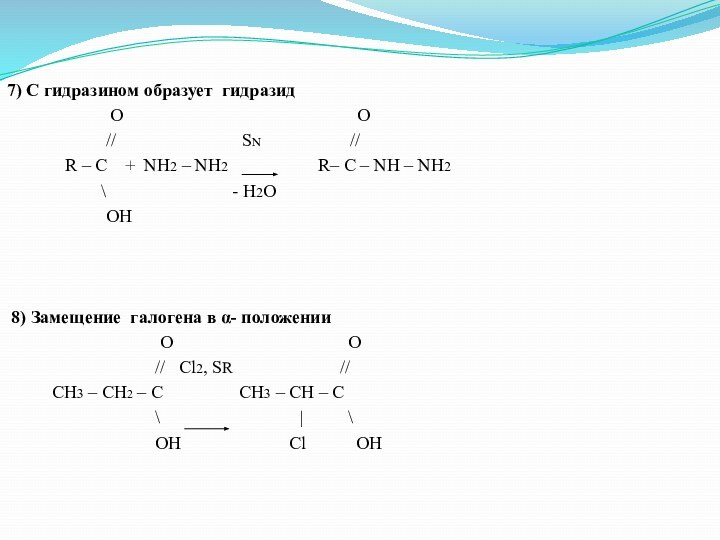
- 25. 7) С гидразином образует гидразид
- 27. Особые свойства муравьиной кислоты.
- 29. Дикарбоновые кислоты Дикарбоновые кислоты проявляют все
- 30. 2)
- 31. Дикарбоновые кислоты проявляют особые свойства:При высокой температуре
- 32. Янтарная и глутаровая кислоты при высокой
- 34. При нагревание с концентрированной H2SO4
- 35. Отдельные представители :
- 36. Скачать презентацию
- 37. Похожие презентации
План:Способы получения карбоновых кислот. Строение карбоксильной группы и карбоксильного иона.Реакционная способность кислот.Функциональные производные карбоновых кислот: хлорангидриды, ангидриды, сложные эфиры, амиды, нитрилы.
























Слайд 2
План:
Способы получения карбоновых кислот.
Строение карбоксильной группы и
карбоксильного иона.
сложные эфиры, амиды, нитрилы.
Слайд 3
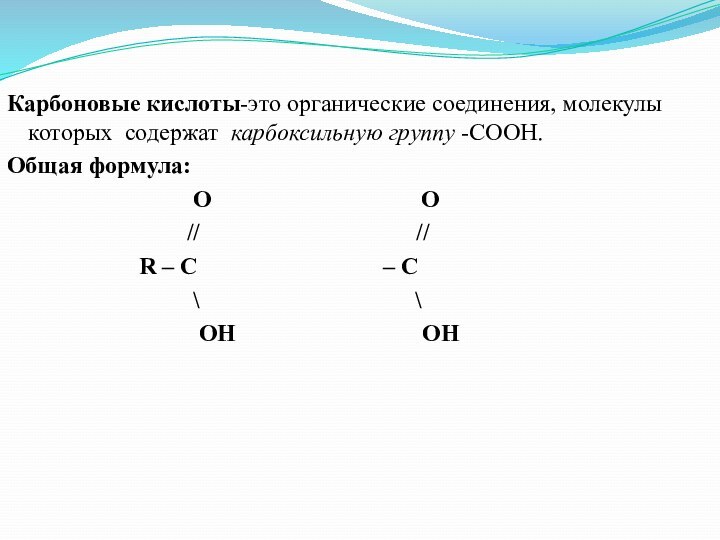
Карбоновые кислоты-это органические соединения, молекулы которых содержат карбоксильную
группу -СООН.
Общая формула:
O O// //
R – C – C
\ \
OH OH
Слайд 4
Карбоксильная группа относится к сложным функциональным группам, так
как
содержит карбонильную и гидроксильную группы, которые оказывают
взаимное влияние друг
на друга. Неподеленная электронная пара атома кислорода в гидроксильной группе смещена в сторону
карбонильного углерода, на котором находится частичный положительный
заряд. Вследствие этого связь О-Н становится менее прочной, что
увеличивает кислотные свойства соединения (легче отщепляется протон
Н+ .
σ-
O
σ+//
R – C σ- σ+
O H
Слайд 5
С другой стороны, подача электронной плотности от
гидроксильного атома кислорода уменьшает частичный положительный заряд на
атоме углерода и тем самым ослабляет активность карбонильной группы С=О.По числу карбоксильных групп в молекуле карбоновые кислоты делят на монокарбоновые или одноосновные (одна карбоксильная группа), дикарбоновые или двухосновные (две карбоксильные группы) и т.д..
В зависимости от структуры углеводородного радикала кислоты могут быть предельными и непредельными ,алифатическими, циклическими, ароматическими:
O
//
CH3 – C уксусная кислота, этановая кислота
\
OH
O
//
CH2 = CH – C акриловая кислота, пропеновая кислота
\
OH
Слайд 6
По номенклатуре ИЮПАК (по международной номенклатуре) карбоновые кислоты
рассматриваются как производные углеводородов , названия которых используются как
корень слова с прибавлением окончания -овая кислота ( метановая кислота, пропановая кислота и т.д.). Названия двухосновных карбоновых кислот составляют с использованием окончания -диовая кислотаДля органических кислот широко распространены тривиальные названия, которые чаще всего связаны с природными источниками получения соответствующих кислот: масляная, яблочная,щавелевая, молочная, лимонная и т.д.
Если в молекуле кислоты есть заместители, то перед названием кислоты цифрой или буквой из греческого алфавита указывают их положение и название. Нумерация атомов углерода производят ,начиная с атома углерода карбоксильной группы. Буквой α
обозначают атом углерода , непосредственно связанный с карбоксильной группой, следующие за ним атом обозначают буквой β и т.д.
O
4 3 2 1 //
СН2=СН- СН - C 2-метилбутен-3-овая кислота
| \
СН3 OH
O
α //
CH3 – CH – C 2-метилпропановая кислота, α-метилпропионовая кислота
| \
СН3 ОН
Слайд 7
По рациональной номенклатуре карбоновые кислоты являются производными
уксусной кислоты.
Например:
Монокарбоновые кислоты
O //
H – C муравьиная кислота, метановая кислота
\
OH
O
//
CH3 – C уксусная кислота, этановая кислота
\
OH
O
//
CH3 – CH2 – C пропионовая кислота, пропановая кислота, 2-метилуксусная
\ кислота (РН)
OH
Слайд 8
O
//
CH3 – CH – C изомасляная кислота, 2-метилпропановая кислота,
| \ 2,2-диметилуксусная кислота
CH3 OH
O
//
CH2 = CH – C акриловая кислота, пропеновая кислота
\
OH
O
//
CH3 – CH = CH – C кротоновая кислота, бутен–2-кислота
\
OH
Слайд 9
Дикарбоновые кислоты
НООС – СООН
этандикарбоновая кислота, щавелевая кислота
НООС – СН2 – СООН пропандиовая кислота, малоновая кислота
НООС – СН2 – СН2 – СООН бутандиовая кислота, янтарная кислоты
НООС – СН2 – СН2 – СН2 – СООН пентандиовая кислота, глутаровая кислота
НООС – (СН2)4 – СООН гександиовая кислота, адипиновая кислота
Слайд 10
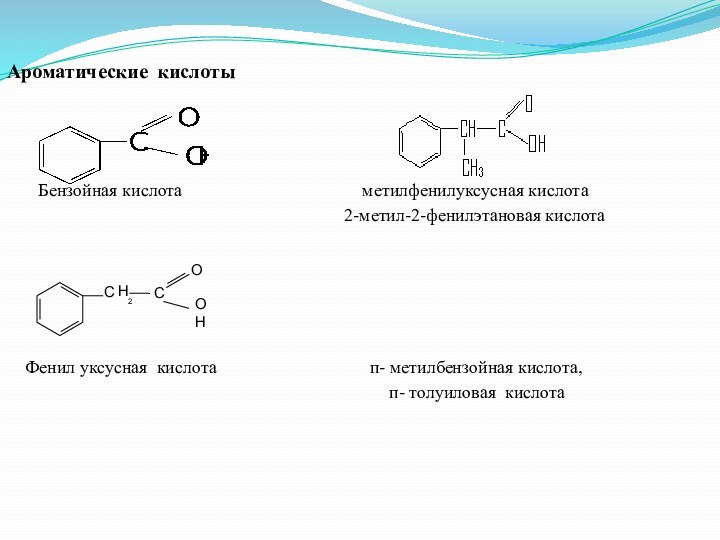
Ароматические кислоты
Бензойная кислота метилфенилуксусная кислота
2-метил-2-фенилэтановая кислота
Фенил уксусная кислота п- метилбензойная кислота,
п- толуиловая кислота
Слайд 11
Способы получения:
1) Гидролиз сложных эфиров:
O O
// H2O, H+ //
CH3 – C CH3 – C + C2H5OH
\ \
O – C2H5 OH
этилэтаноат или этилацетат
2) Окисление альдегидов и первичных спиртов:
H OH O O
/ [O] / // [O] //
CH3 – C – OH CH3 – C – OH CH3 – C CH3 – C
\ \ -H2О \ \
H H H OH
Слайд 12
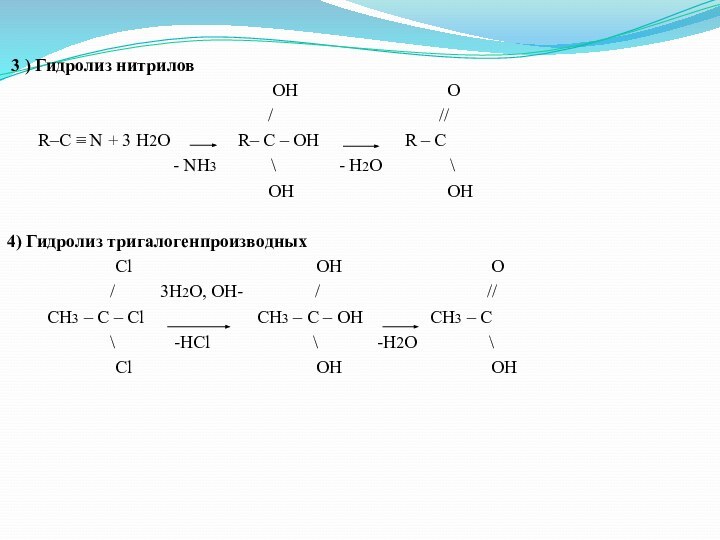
3 ) Гидролиз нитрилов
OH O
/ //
R–C ≡ N + 3 H2O R– C – OH R – C
- NH3 \ - H2O \
OH OH
4) Гидролиз тригалогенпроизводных
Cl OH O
/ 3H2O, OH- / //
CH3 – C – Cl CH3 – C – OH CH3 – C
\ -HCl \ -H2O \
Cl OH OH
Слайд 13
5)Получение с помощью реактива Гриньяра и СО2
R –
Br + Mg этил. эфир R – Mg – Br (реактив Гриньяра )O O O
// // HOH //
R– Mg – Br + C R – C R – C + Mg (OH) Br
\\ \ \
O OMgBr OH
6)Ароматические кислоты получают из гомологов бензола:
Слайд 14
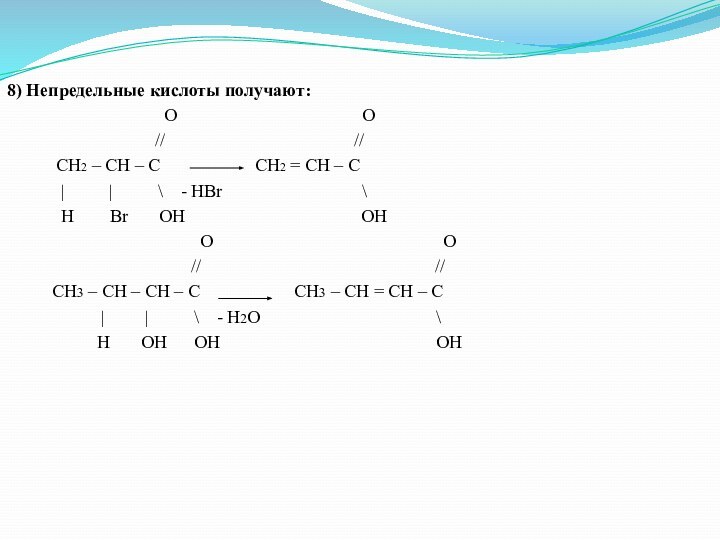
8) Непредельные кислоты получают:
O O
// //
CH2 – CH – C CH2 = CH – C
| | \ - HBr \
H Br OH OH
O O
// //
CH3 – CH – CH – C CH3 – CH = CH – C
| | \ - H2O \
H OH OH OH
Слайд 15
Физические свойства:
Карбоновые кислоты до С3 – легкоподвижные жидкости,
с резким запахом, с водой смешиваются в
любых соотношениях. С
бутановой кислоты (С4) до ( – С9) – маслянистые жидкости, с неприятнымзапахом. С С10 – и выше твердые вещества , не растворимые в воде. С увеличением молярной массы
карбоновых кислот растворимость в воде уменьшается Плотность уксусной и муравьиной кислот
выше 1, у других –ниже 1.
В сравнение со спиртами у карбоновых кислот температуры кипения выше , так как образуются
прочные ассоциаты за счет межмолекулярных водородных связей:
Межмолекулярные связи:
O …..НО
// \
CH3 – C С – СН3
\ //
OH….. О
Образование ассоциатов
Слайд 16
Химические свойства карбоновых кислот зависят от электронного строения
карбоксильной группы:
атом углерода в карбоксиле находится в sp2 гибридном
состоянии,связь между атомами углерода икислорода одна–σ; другая –π. Электроотрицательность атома кислорода выше, чем у атома углерода,
поэтому π- электроны смещены в сторону атома кислорода. р-электроны атома кислорода в
гидроксильной группе перекрываются с π –электронами карбонильной группы, в связи с чем
образуется р, π -перекрывание (мезомерный эффект +М).
σ-
O
σ+ //
R – C -J< + M
sp2 σ- σ+
O H
Слайд 17
Благодаря этому электронному эффекту связь между атомом водорода
и кислорода еще больше поляризуется. Поэтому карбоновые кислоты легко
отдают протон, проявляя кислотные свойства.Строение карбоксилат- иона:
Заряды равномерно распределены между связями, поэтому карбоксилат-ионы устойчивы.
Слайд 18
По теории Бренстеда- Лоури карбоновые кислоты относятся
к ОН -кислотам .
В водных растворах карбоновые кислоты
диссоциируют :R – COOH + H2O ↔ R- COO- + H3O+
карбоксилат гидроксоний
ион катион
Карбоновые кислоты являются слабыми кислотами.
Сила кислоты определяется величиной константы ионизации, которая зависит от природы заместителя R, связанного с карбоксильной группой.
Электронодонорные заместители, подавляя электронную плотность на атоме углерода карбоксильной группы, уменьшают частичный положительный заряд на нем. Следствием этого является уменьшение поляризации связи О-Н и ослабление силы кислоты. С увеличением предельного алифатического радикала сила кислот и константа диссоциации уменьшается .
Электроноакцепторные заместители , оттягивая на себя электронную плотность, способствуют большей поляризации связи О-Н, что приводит к повышению кислотных свойств .
Слайд 19
Карбоновые кислоты по своему электронному строению склонны
к реакциям нуклеофильного замещения (SN) (реакции этерификации, получение галоген
ангидридов, ангидридов, амидов, гидразидов).O - O O
// - / //
R – C + Nu R– C – Nu R– C
\ \ \
OH X Nu
Слайд 20
1) Кислотные свойства проявляются в образовании солей (
с металлами, оксидами , гидроксидами, карбонатами, гидрокарбонатами)
O O// //
CH3 – C + NaOH CH3 – C + H2O
\ \
OH ONa
Натриевая соль уксусной кислоты
ацетат натрия
натрия этаноат
2) Со спиртами карбоновые кислоты образуют сложные эфиры ( Все карбоновые кислоты взаимодействуют по этому механизму):
O O
// H+ //
CH3 – C + C2H5 OH CH3 – C
\ \
OH OC2H5
Этиловый эфир уксусной кислоты
этил этаноат
этилацетат
Слайд 21
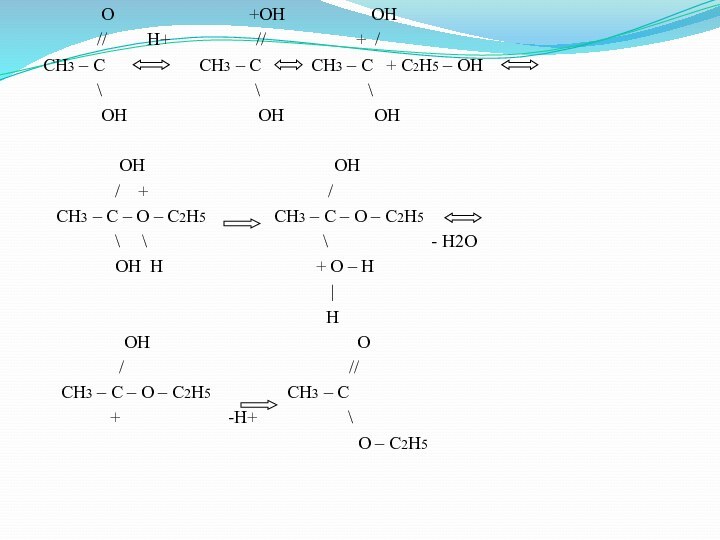
O
+OH OH// H+ // + /
CH3 – C CH3 – C CH3 – C + C2H5 – OH
\ \ \
OH OH OH
OH OH
/ + /
CH3 – C – O – C2H5 CH3 – C – O – C2H5
\ \ \ - H2O
OH H + O – H
|
H
OH O
/ //
CH3 – C – O – C2H5 CH3 – C
+ -H+ \
O – C2H5
Слайд 22
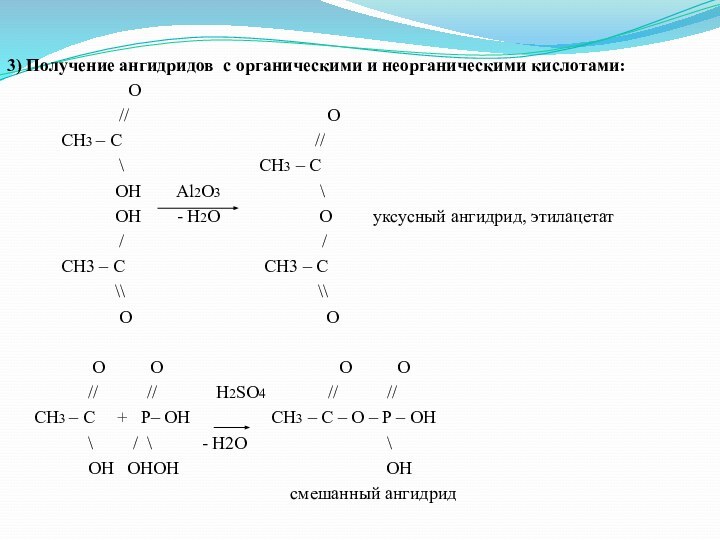
3) Получение ангидридов с органическими и неорганическими кислотами:
O
// O
CH3 – C //
\ CH3 – C
OH Al2O3 \
OH - H2O O уксусный ангидрид, этилацетат
/ /
CH3 – C CH3 – C
\\ \\
O O
O O O O
// // Н2SO4 // //
CH3 – C + P– OH CH3 – C – O – P – OH
\ / \ - H2O \
OH OHOH OH
смешанный ангидрид
Слайд 23
4) Получение галогенангидридов:
// //
H – C + PCl5 H – C + POCl3 + HCl ( Н-СОС1-хлорный метаноил
\ \ формил хлорид
ОН Cl хлорангидрид муравьиной кислоты
H – COOH + PCl3 → H – COCl + H3PO3
H – COOH + SOCl2 → H – COCl + SO2 + HCl
Слайд 24
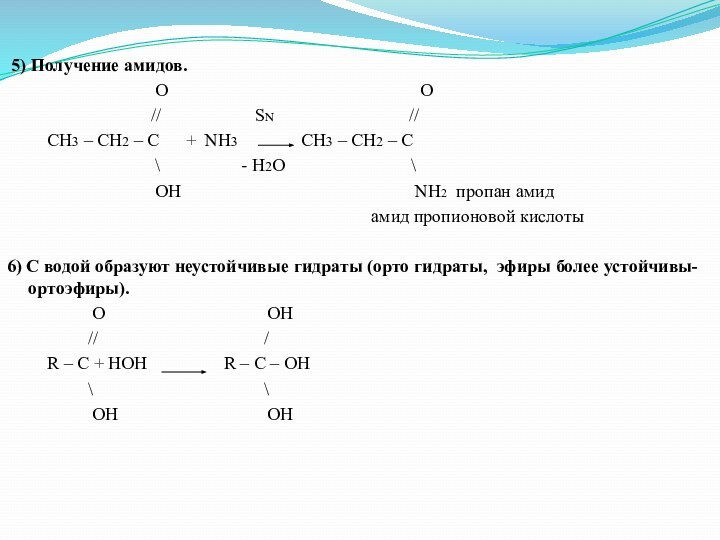
5) Получение амидов.
O O
// SN //
CH3 – CH2 – C + NH3 CH3 – CH2 – C
\ - H2O \
OH NH2 пропан амид
амид пропионовой кислоты
6) С водой образуют неустойчивые гидраты (орто гидраты, эфиры более устойчивы- ортоэфиры).
O OH
// /
R – C + HOH R – C – OH
\ \
OH OH
Слайд 25
7) С гидразином образует гидразид
O O
// SN //
R – C + NH2 – NH2 R– C – NH – NH2
\ - H2O
OH
8) Замещение галогена в α- положении
O O
// Cl2, SR //
CH3 – CH2 – C CH3 – CH – C
\ | \
OH Cl OH
Слайд 26
9)
Под действием ферментов при нагревании карбоновые кислоты подвергаются
декарбоксилированию.O
// t0
R – C R – H + CO2
\
OH
Слайд 27
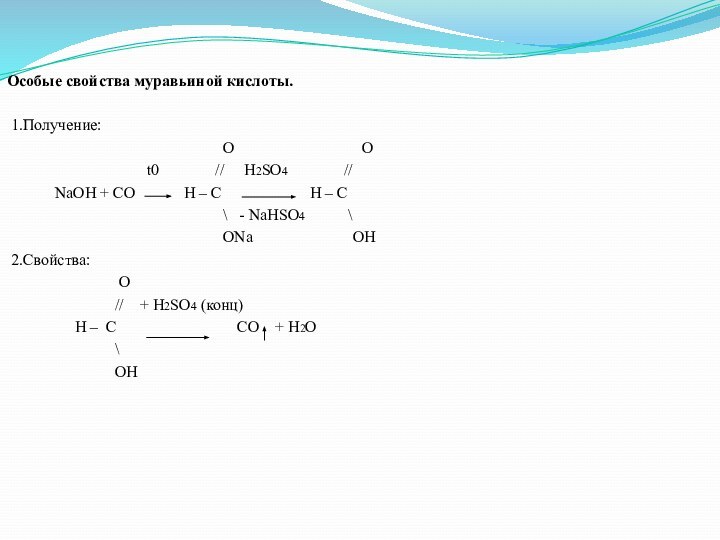
Особые свойства муравьиной кислоты.
1.Получение:
O O
t0 // H2SO4 //
NaOH + CO H – C H – C
\ - NaHSO4 \
ONa OH
2.Свойства:
O
// + H2SO4 (конц)
H – С CO + H2O
\
OH
Слайд 28
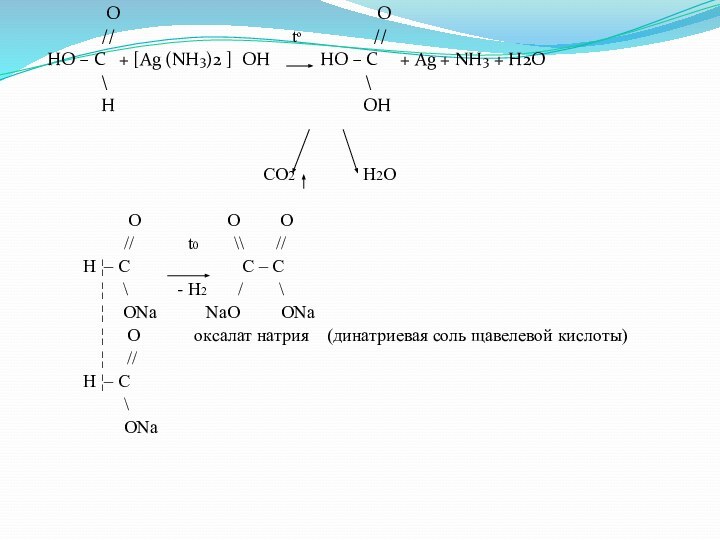
O
O// tº //
HO – C + [Ag (NH3)2 ] OH HO – C + Ag + NH3 + H2O
\ \
H OH
CO2 H2O
O O O
// t0 \\ //
H ¦– C C – C
¦ \ - H2 / \
¦ ONa NaO ONa
¦ O оксалат натрия (динатриевая соль щавелевой кислоты)
¦ //
H ¦– C
\
ONa
Слайд 29
Дикарбоновые кислоты
Дикарбоновые кислоты проявляют все химические
свойства монокарбоновых кислот. Они образуют моно- и дизамещенные производные.
Дикарбоновые кислоты диссоциируют ступенчато:HOOC – COOH HOOC – COO- + H+ -OOC – COO- + H+
1) HOOC – COONa NaOOC – COONa
моно Na соль ди Na соль
Слайд 30
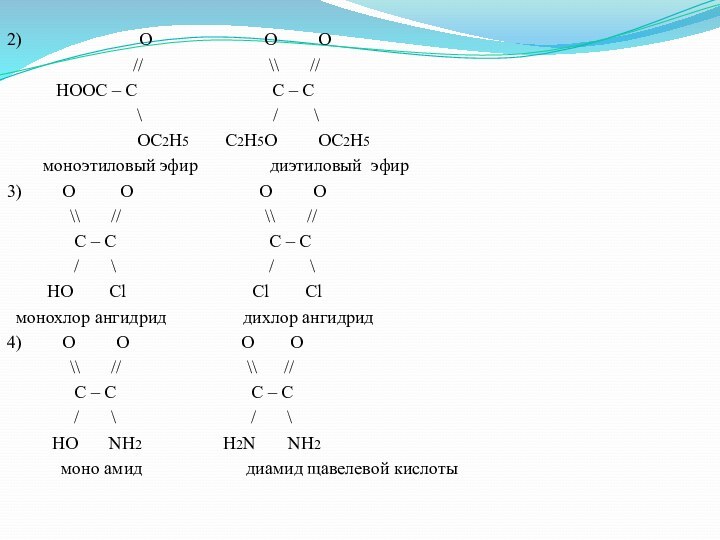
2)
O
O O// \\ //
HOOC – C C – C
\ / \
OC2H5 C2H5O OC2H5
моноэтиловый эфир диэтиловый эфир
3) O O O O
\\ // \\ //
C – C C – C
/ \ / \
HO Cl Cl Cl
монохлор ангидрид дихлор ангидрид
4) O O O O
\\ // \\ //
C – C C – C
/ \ / \
HO NH2 H2N NH2
моно амид диамид щавелевой кислоты
Слайд 31
Дикарбоновые кислоты проявляют особые свойства:
При высокой температуре щавелевая
и малоновая кислоты декарбоксилируются с образованием монокарбоновых кислот.
O O O\\ // tº //
C – C H – C + CO2
/ \ \
HO OH OH
O O O
\\ // tº //
C – CH2 – C CH3 – C + CO2
/ \ \
HO OH OH
Слайд 32
Янтарная и глутаровая кислоты при высокой температуре
выделяют воду и образуют циклические ангидриды.
O O// //
CH2 – C CH2 – C
\ / \
CH2 OH tº CH2 O + H2O
OH - H2O \ /
/ CH2 – C
CH2 – C \\
\\ O
O
Слайд 33
O
//
CH2 – CH2 – C
\ CH2 – CH2
CH2 OH tº / \
OH - H2O CH2 C = O
/ - CO2 \ /
CH2 – CH2 – C CH2 – CH2
\\ циклический кетон
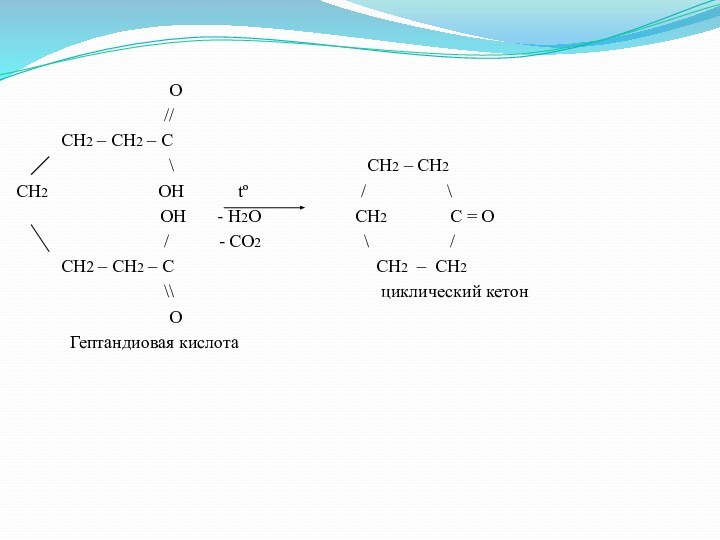
O
Гептандиовая кислота
Слайд 34
При нагревание с концентрированной H2SO4
Щавелевая кислота при нагревании с концентрированной H2SO4 кислотой
разлагается на CO2, СО и H2O .O O
\\ // tº H2SO4 (конц)
C – C CO2 + CO + H2O
/ \
HO OH
Слайд 35
Отдельные представители :
Щавелевая
кислота
O
O \\ //
C – C соли оксалаты
/ \
HO OH
Окисление щавелевой кислоты
[O]
HOOC – COOH 2 CO2 + H2O