- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Щелочные металлы 9 класс
Содержание
- 2. ЩЕЛОЧНЫЕ МЕТАЛЛЫЩелочны́е мета́ллы — элементы главной подгруппы I
- 3. Общая характеристика щелочных металловВ Периодической системе они
- 4. Все металлы этой подгруппы имеют серебристо-белый цвет
- 5. Химические свойства щелочных металловИз-за высокой химической активности
- 6. 2. Взаимодействие с кислородом. Продукты горения щелочных
- 7. Для получения оксидов натрия и калия нагревают
- 8. Оксиды щелочных металлов обладают всеми свойствами, присущими
- 9. 3. Взаимодействие с другими веществами. Щелочные металлы
- 10. 4. Качественное определение щелочных металлов. Поскольку потенциалы
- 11. ЛитийСамый легкий металл, имеет два стабильных изотопа
- 12. НатрийИзвестен с древности, выделил его Х.Дэви в
- 13. КалийИзвестен с древности, выделил его также Х.Дэви
- 14. РубидийРубидий был открыт методом спектроскопии Р.Бунзеном в
- 15. ЦезийСоединения цезия широко распространены в природе, обычно
- 16. Скачать презентацию
- 17. Похожие презентации















Слайд 3
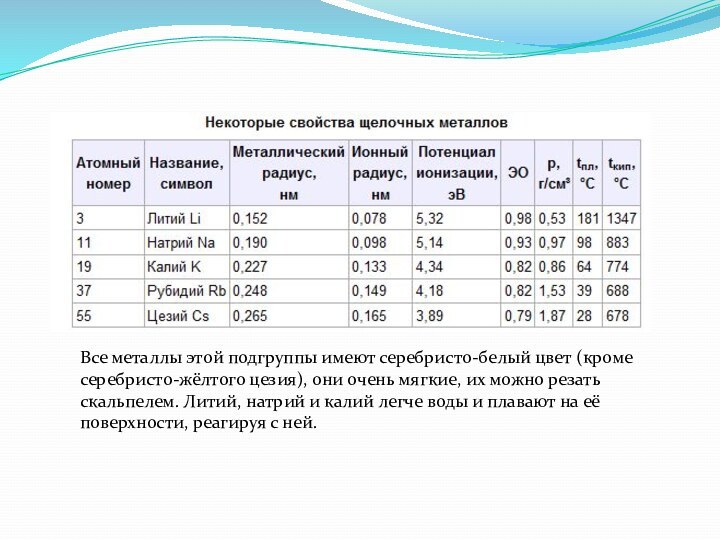
Общая характеристика щелочных металлов
В Периодической системе они следуют
сразу за инертными газами, поэтому особенность строения атомов щелочных
металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1. Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО).Слайд 4 Все металлы этой подгруппы имеют серебристо-белый цвет (кроме
серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем.
Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Слайд 5
Химические свойства щелочных металлов
Из-за высокой химической активности щелочных
металлов по отношению к воде, кислороду, и иногда даже
и азоту (Li, Cs) их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
Слайд 6 2. Взаимодействие с кислородом. Продукты горения щелочных металлов
на воздухе имеют разный состав в зависимости от активности
металла.Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
Слайд 7 Для получения оксидов натрия и калия нагревают смеси
гидроксида, пероксида или надпероксида с избытком металла в отсутствие
кислорода:Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22−и надпероксид-ион O2−.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
Слайд 8 Оксиды щелочных металлов обладают всеми свойствами, присущими основным
оксидам: они реагируют с водой, кислотными оксидами и кислотами:
Пероксиды
и надпероксиды проявляют свойства сильных окислителей:Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
Слайд 9 3. Взаимодействие с другими веществами. Щелочные металлы реагируют
со многими неметаллами. При нагревании они соединяются с водородом
с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов:При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами.
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах:
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака: