- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Строение атома.
Содержание
- 2. В XX в. ученые установили, что атом
- 3. В 1911 году английский ученый Э. Резерфорд
- 4. Было установлено, что заряды ядер атомов химических
- 6. С развитием учения о строении атома был
- 7. Дальнейшие исследования показали, что ядро атома имеет
- 8. Протон (p) — это частица с зарядом
- 9. Заряд протона по абсолютному значению равен заряду
- 10. Нейтрон (n) — частица с массой, равной 1, но не имеющая заряда.
- 11. Число протонов и нейтронов в составе различных
- 12. По относительной атомной массе (Ar) и порядковому
- 13. Скачать презентацию
- 14. Похожие презентации
В XX в. ученые установили, что атом состоит из ядра и движущихся вокруг него электронов. Была разработана теория строения атома.









Слайд 3 В 1911 году английский ученый Э. Резерфорд предложил
"планетарную" модель строения атома. Согласно этой модели, в центре
атома находится положительно заряженное ядро, вокруг которого вращаются электроны. Электрон имеет наименьший отрицательный заряд, который был принят за единицу. В целом атом электронейтрален, т.е. не имеет заряда. Положительный заряд ядра равен сумме отрицательных зарядов электронов. Например, если ядро атома имеет заряд +4, то вокруг него движутся 4 электрона, каждый из которых имеет заряд, равный -1.Слайд 4 Было установлено, что заряды ядер атомов химических элементов
численно равны их порядковому номеру в периодической системе Д.
И. Менделеева. Так был открыт физический смысл порядкового номера элемента. Порядковый номер водорода равен 1, заряд ядра его атома — +1, вокруг его ядра движется один электрон с отрицательным зарядом -1. Порядковый номер элемента гелия — 2, заряд ядра — +2, вокруг ядра его атома движутся два электрона с общим отрицательным зарядом -2.Слайд 6 С развитием учения о строении атома был выявлен
физический смысл Периодического закона. В настоящее время его формулируют
так: свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атомов этих элементов.Слайд 7 Дальнейшие исследования показали, что ядро атома имеет сложное
строение. В состав атомного ядра входят такие частицы, как
протоны и нейтроны.Слайд 8 Протон (p) — это частица с зарядом +1
и относительной атомной массой, равной 1. Число протонов в
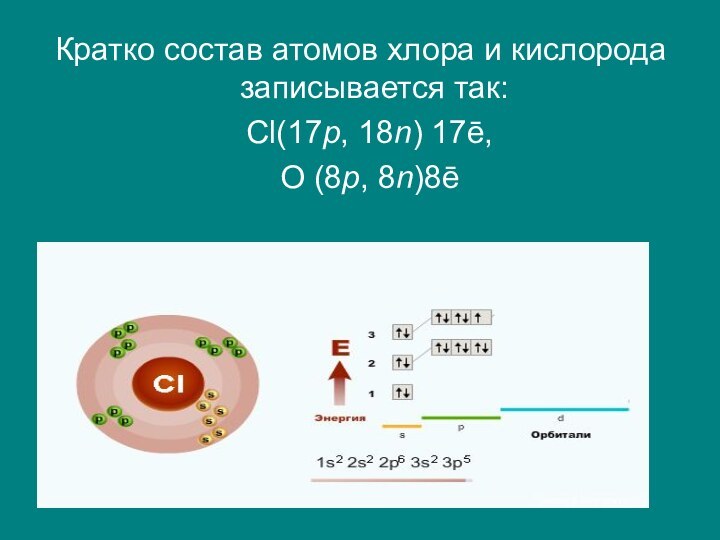
ядре равно заряду ядра атома элемента и его порядковому номеру (Z). Например, порядковый номер элемента кислорода равен 8. Значит, число протонов в ядре атома кислорода равно 8 и заряд его ядра равен +8. Порядковый номер элемента хлора — 17. В состав его ядра входят 17 протонов, а заряд его ядра равен +17.Слайд 9 Заряд протона по абсолютному значению равен заряду электрона
(ē). Поэтому любой атом является электронейтральной частицей, так как
положительный заряд всех протонов равен отрицательному заряду всех электронов. И число электронов равно числу протонов. В атоме хлора —17ēСлайд 11 Число протонов и нейтронов в составе различных атомов
различно. Практически вся масса атома(99,95%) сосредоточена в ядре, находящемся
в его центре. Относительная атомная масса элемента численно равна сумме масс протонов и нейтронов:Ar= Z + N,
где Z — сумма масс всех протонов, численно равная порядковому номеру; N —сумма масс всех нейтронов, численно равная количеству нейтронов в атоме.
Слайд 12 По относительной атомной массе (Ar) и порядковому номеру
(Z) можно рассчитать число нейтронов (N) следующим образом:
N= Ar
- Z.Для хлора число нейтронов в ядре его атома равно:
N=35 - 17= 18.