Слайд 2
План
1. Определение предмета орг. химии.
2. Признаки органических веществ.
3.
Особенности углерода.
4. Виды ковалентной связи, тип гибридизации электронных облаков.
5. Классификация органических веществ.
6. Круговорот углерода в природе.
Слайд 3
1. Органическая химия – наука о соединениях углерода,
их свойствах, строении и превращениях.
2. Признаки органических веществ:
а) горение
с образованием углекислого газа и воды;
б) разложение при нагревания с выделением углерода (сажа);
в) почти все имеют молекулярную кристаллическую решетку.
Слайд 4
3. В учебнике «Основы химии» Д.И.Менделеев писал: «Способность
атомов углерода соединяться между собой и давать сложные частицы
проявляется во всех углеродистых соединениях. Ни в одном из элементов способности к усложнению не развито в такой степени, как в углероде. Ни одна пара элементов не дает столь много соединений, как углерод с водородом.»
Ученые А. Кекуле и А. Купер установили, что углерод всегда четырехвалентен и способен образовывать углерод - углеродные цепи.
Кроме этого, строение атомов углерода позволяет образовывать простые и кратные связи.
Слайд 5
В органических веществах существуют, в основном, ковалентные химические
связи:
а) А. + .А =
А:А б) А: + :А = А: :А
Ковалентные связи делятся на сигма(σ) -связь и пи(π)-связь.
а) Если наибольшая электрнная плотность находится на прямой между ядрами атомов – это сигма(σ)-связь.
Слайд 6
б) Если наибольшая электронная плотность
находится под углом к
ядрам атомов, такая
ковалентная связь называется пи(π) - связью.
ПРИМЕЧАНИЕ:
При
наличии между двумя атомами ХЭ
2-х или 3-х химических связей одна из них будет сигма-связь, а остальные - пи-связи.
Слайд 7
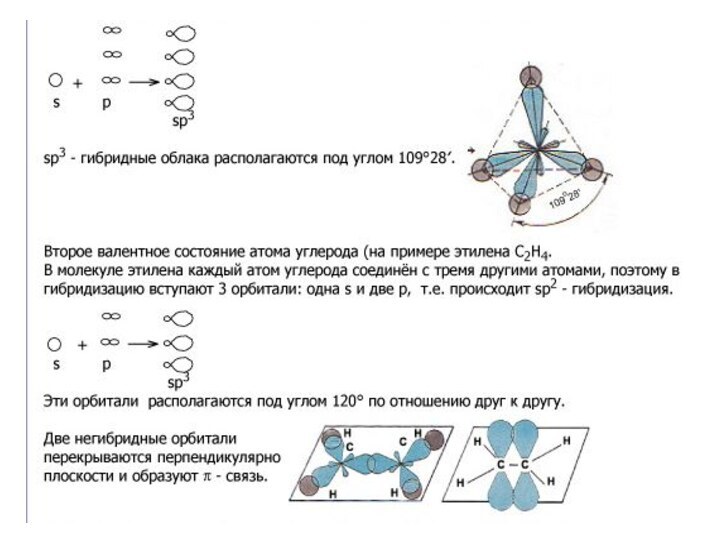
В образовании сигма (σ)-связи участвуют гибридизованные электронные облака.
Гибридизация – это выравнивание электронных облаков по
форме, величине и энергии.
Существует три типа гибридизации:
а) sp3 – гибридизация;
б) sp2 – гибридизация;
в) sp – гибридизация.
В органических веществах гибридизации подвергаются электронные облака атомов углерода. От типа гибридизации зависит строение органических веществ, а, следовательно, свойства.
Слайд 9
Органические соединения делятся на три большие группы:
1. Углеводороды.
2.
Кислородсодержащие.
3. Азотсодержащие.
Классы углеводородов отличаются типом гибридизации и числом пи
- связей.
Слайд 10
Кислородсодержащие органические вещества делятся на спирты, простые эфиры,
альдегиды, карбоновые кислоты, сложные эфиры, углеводы и т. д..
Азотсодержащие:
амины, аминокислоты, белки, нуклеиновые кислоты.
6 CO2 + 6 H2 O = C6 H12 О6 + 6 О2
Фотосинтез
Слайд 11
Ковалентные связи, образующие органичес-
кие вещества, могут разрушаться под
дейст-
вием природных факторов, поэтому углерод
совершает непрерывный круговорот в при-
роде.
Д/З:
конспект, №1, з.6 (5), вопросы 2, 3, 4.
Слайд 12
УРОК № 2
Теория строения
органических
соединений.
Слайд 13
План урока
1.Письменный опрос:
а)В чем заключается виталистическая
теория Берцелиуса?
Крах вит. теории.
б)Перечислить особенности орг. соед-й.
в)Строение атома углерода. Определение
понятия
гибридизации.
г) Типы ковалентной связи. Изобразить
схемы образования.
д)Виды гибридизации.
Слайд 14
2.Основные положения ТХС.
3.Понятия валентности, гомологии,
изомерии.
4.Структурные формулы орг.
соединений.
Д/З №2, составить формулы двух
гомологов и двух изомеров к
С6Н14(гексан)
Подготовиться к зачету «ТХС, гомологи,
изомеры».
Слайд 17
Атомы, соединенные в молекулу, взаимно влияют друг
на друга.
Наибольшее влияние оказывают атомы,
соединенные непосредственно.
Структурные формулы показывают
порядок соединения
атомов в молекуле.
Следовательно, для каждого вещества
существует только одна формула
строения.
Слайд 18
1.Валентность – это свойство атомов ХЭ образовывать определенное
число химических связей.
2.Вещества, которые имеют одинаковый
качественный состав и сходное
строение,
но отличаются друг от друга на группу
атомов -СН2 - (одну или несколько),
называются гомологами.
Слайд 19
Гомологический ряд метана:
СН4,
С2Н6, С3Н8,
С4Н8
Метан Этан Пропан Бутан
Гомологический ряд этилена:
С2Н4, С3Н6 С4Н8 С5Н10
Этен Пропен Бутен Пентен
Гомологический ряд ацетилена:
С2Н2, С3Н4 С4Н6 С5Н8
Этин Пропин Бутин Пентин
Слайд 20
3.Изомеры – это в – ва, которые имеют
одинаковую
молекулярную формулу
(качественный и количественный состав),
но разное строение.
Слайд 23
Урок №3
Предельные
углеводороды
(алканы,
парафины )
План
1.Определение алканов.
2.Строение молекулы:
а)первое
валентное состояние углерода
б)пространственное строение молекул
в)изомерия и номенклатура алканов
3.Физические свойства.
4.Зачет по теме«ТХС,гомологи, изомеры»
Слайд 25
Предельные УВ (алканы, парафины) -
это соединения,
в которых химические
связи углерода до предела насыщены
атомами водорода.
С5Н12, С6Н14 С7Н16 С8Н18
Пентан Гексан Гептан Октан
С9Н20 – нонан С10Н22 - декан
СnH2n+2 – общая формула парафинов.
Гомологический ряд метана:
СН4, С2Н6, С3Н8, С4Н8
Метан Этан Пропан Бутан
Слайд 26
В молекулах алканов существует
малополярная (s –
p) и неполярная (р – р)
сигма – связь. Эта
связь очень прочная и
малополяризуемая, поэтому данные УВ
являются устойчивыми, на них не
действуют при обычных условиях р – ры
кислот, щелочей и окислители.
(Pаrаfinоs – пассивный (греч.)).
Слайд 27
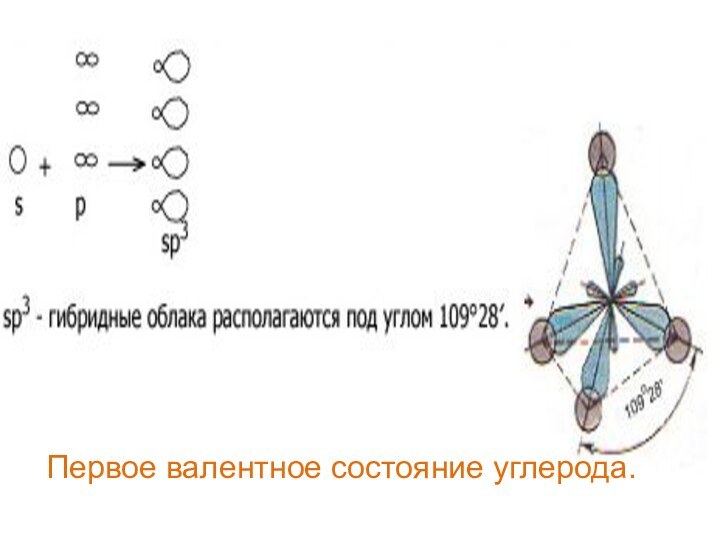
Первое валентное состояние углерода.
Слайд 28
В алканах атомы углерода находятся в
sp3- гибридизации.
Это первое
валентное состояние атомов углерода.
Гибридизованные электронные облака
взаимно
отталкиваются и образуют угол
109о 28/ . Длина С – С связи составляет
0,154 нм. Вследствие этого молекулы
приобретают тетраэдрическое строение и
в пространстве имеют вид зигзага (если
С > 3).
Слайд 29
В ряду алканов существует изомерия по
разветвлению углеродного
скелета. В р – х
изомеризации УВ нормального строения
превращаются в
разветвленные. CH3
CH3- CH2- CH2-CH2-CH3 -> H3C - C - CH3
н - пентан СН3
2,2 – диметилпропан
Катализатор реакции – Al Cl3, to .
**Составьте формулу 2,3 – диметилбутана.
Слайд 30
Физические свойства алканов
Таблица с.
26, учебник.
Слайд 31
Вывод:
Изменение физических свойств парафинов
подтверждают один
из законов диалектики –
переход количества в качество.
4. Зачетная работа: с.32, упр.7, 8.
1в.- б, определение валентности.
2в.- в, 1-е положение ТХС.
3в.- г, 2-е положение ТХС.
4в.- упр.8 , 3-е положение ТХС.
Д/з: №3, в упр.7 назвать в – ва, з.12, в-сы 9,10.