- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Железо и его соединения
Содержание
- 2. ТЕМа : «ЖЕЛЕЗО» Работу выполнила:Учитель химии Кильсенбаева А.А.
- 3. С О Д Е Р Ж А
- 4. Нахождение в природе В земной коре на
- 5. Первое металлическое железо, попавшее в руки человека,
- 6. Наиболее распространенныеи добываемые руды и минералы
- 8. Физические свойства железасеребристо-серый тугоплавкий (Т пл.=15350C)Тяжелый (плотность=7,8 г\см3 )ковкий; пластичный;обладает магнитными свойствами; прочныйтеплопроводный;электропроводный;
- 10. Взаимодействие железа с кислородом
- 12. Взаимодействие железа с хлором
- 14. Взаимодействия железа с серой
- 16. Взаимодействие железа с водой Для проведения этой
- 17. Железо разрушается под действием окружающей среды, т.е.
- 19. Взаимодействия железа с азотной кислотой
- 21. Железо в организмеЖелезо в виде ионов присутствует
- 22. Основная роль железа в организме – участие
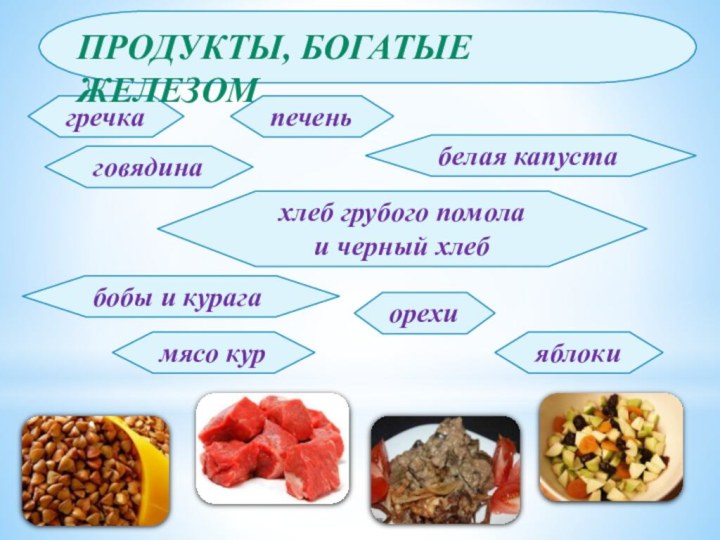
- 23. гречкаговядинапеченьбелая капустахлеб грубого помола и черный хлеббобы и курагаорехимясо куряблокиПродукты, богатые Железом
- 24. 1.С помощью соляной кислоты можно
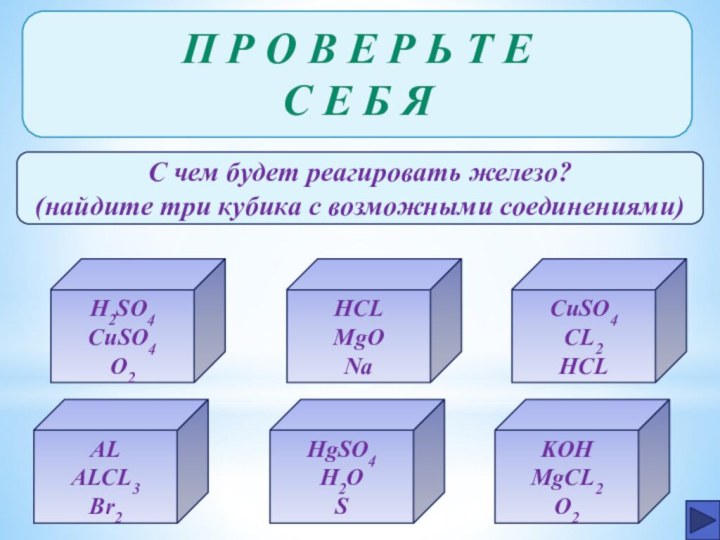
- 25. П Р О В Е Р Ь
- 26. Скачать презентацию
- 27. Похожие презентации






















Слайд 3 С О Д Е Р Ж А Н
И Е
Положение
В периодической системе, строение атома
НАХОЖДЕНИЕ
В ПРИРОДЕ
ХИМИЧЕСКИЕ СВОЙСТВА
ПРИМЕНЕНИЕ ЖЕЛЕЗА
И ЕГО СПЛАВОВЖЕЛЕЗО В ОРГАНИЗМЕ И ЕГО РОЛЬ
ФИЗИЧЕСКИЕ
СВОЙСТВА
Слайд 4
Нахождение в природе
В земной коре на долю
железа приходится около 4,1% массы земной коры (4-е место
среди всех элементов, 2-е среди металлов).Известно большое число руд и минералов, содержащих железо.
Оно бывает в виде различных соединений: оксидов, гидроксидов и солей.
В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
Слайд 5 Первое металлическое железо, попавшее в руки человека, имело,
явно, метеоритное происхождение.
Руды железа широко распространены и часто
встречаются даже на поверхности Земли
Железные изделия из метеоритного железа найдены в захоронениях, относящихся к очень давним временам (IV - V тысячелетиях до н.э.), в Египте и Месопотамии
Слайд 6
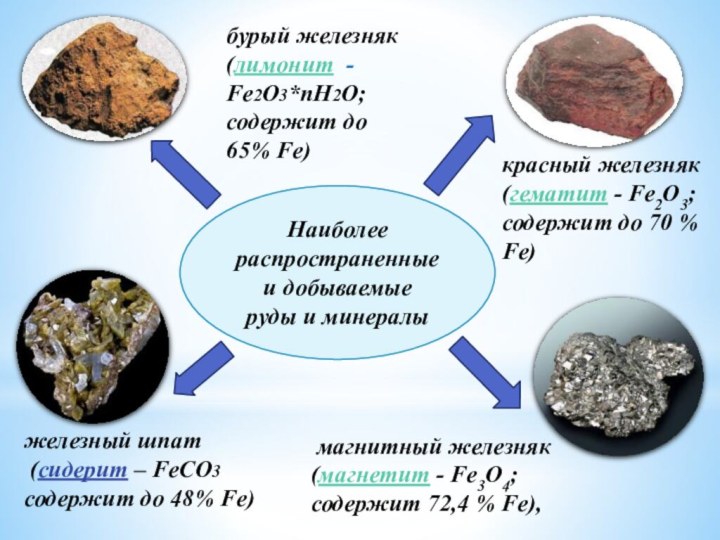
Наиболее
распространенные
и добываемые
руды и минералы
магнитный железняк
(магнетит - Fe3O4;
содержит 72,4 % Fe),
бурый железняк (лимонит -
Fe2О3*пН2О;
содержит до 65% Fe)
красный железняк (гематит - Fe2O3; содержит до 70 % Fe)
железный шпат
(сидерит – FeCO3
содержит до 48% Fe)
Слайд 8
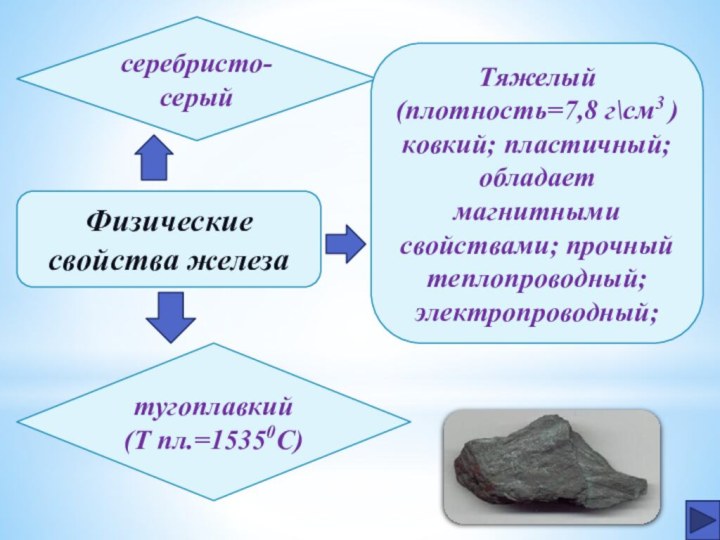
Физические свойства железа
серебристо-серый
тугоплавкий
(Т пл.=15350C)
Тяжелый (плотность=7,8 г\см3
)
ковкий; пластичный;
обладает
магнитными свойствами; прочный
теплопроводный;
электропроводный;
Слайд 16
Взаимодействие железа с водой
Для проведения этой реакции
необходима высокая температура
(700-900 С)
3Fe + 4H2O=Fe3O4 +4H2
(железная окалина)Слайд 17 Железо разрушается под действием окружающей среды, т.е. подвергается
коррозии – «ржавлению».
При этом на поверхности образуется «ржавчина».
4Fe +
6Н2О + ЗО2 = 4Fe(OH)3
Слайд 21
Железо в организме
Железо в виде ионов присутствует в
организмах всех растений и животных и, конечно же, человека,
но в растениях и животных в малых количествах (в среднем 0,02%).Основная биологическая функция железа – участие в транспорте кислорода ко всем органам и окислительных процессах.
В организме человека с массой тела прниблизительно70 кг содержится 4,2 г железа, а в 1 л крови – 450 мг.
При недостатке железа в организме развивается железистая анемия.
Перенос железа в организме осуществляет важнейший белок –гемоглобин, в котором находится больше половины всего железа организма.
Слайд 22 Основная роль железа в организме – участие в
«рождении» красных (эритроцитов) и белых (лимфоцитов) кровяных клеток.
Эритроциты
содержат гемоглобин - переносчик кислорода, а лимфоциты ответственны за иммунитет.Почти 60%, поступающего в организм железа расходуется на синтез гемоглобина.
Некоторое количество (примерно 20%) - откладывается в мышцах, костном мозге, печени и селезенке.
Еще 20% его используется для синтеза различных ферментов.