Слайд 2
Тема проекта: Галогены
Автор проекта: учащиеся 9 класса
Дата выполнения:2009г.
Дополнительно...
Слайд 3
галогены
Главная подгруппа VII группа
Фтор F, хлор Cl, бром
Br, йод I, астат At – типичные неметаллы
На внешнем
энергетическом уровне – 7 электронов
электронная конфигурация
s2p5
До завершения не хватает одного электрона
Самое характерное свойство – присоединение электрона с образованием однозарядного иона
Cl +ē = Cl 1-
Очень сильные окислители
Радиус атома возрастает от фтора к астату
Слайд 4
галогены
Строение атома хлора
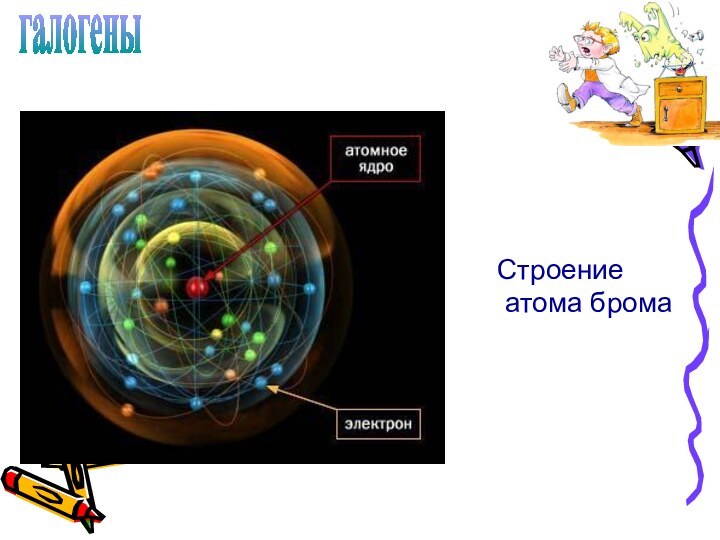
Слайд 5
галогены
Строение
атома брома
Слайд 6
галогены
Каким образом изменяются окислительные свойства галогенов? Почему?
Слайд 7
галогены
Окислительные свойства уменьшаются от фтора к йоду:
с увеличением
порядкового номера
с увеличением радиуса атома
уменьшается значение относительной электроотрицательности
Восстановительные свойства
усиливаются
от хлора к йоду
Окислительные свойства уменьшаются
от фтора к йоду
Слайд 8
галогены
Фтор только окислитель
степень окисления -1
Слайд 9
галогены
Проявляют окислительные свойства в соединениях с металлами, водородом,
менее электроотрицательными элементами (степень окисления -1)
Проявляют восстановительные свойства
в соединениях с более электроотрицательными элементами (степень окисления +1, +3, +5, +7)
Слайд 10
галогены
Радиоактивный элемент.
Наиболее устойчивый его изотоп At210 имеет период
полураспада 8,3 часа («астат» означает «неустойчивый»)
В земной коре его
ничтожно мало.
Получают искусственным путем с помощью ядерных реакций.
Слайд 11
галогены
Молекулы двухатомные
Ковалентная неполярная связь
Молекулярная кристаллическая решетка
F2,Cl2 – газы
Br2
– жидкость
I2 – твердое кристаллическое вещество
простые вещества
Слайд 12
галогены
Фтор –
светло-желтый газ,
с резким раздражающим запахом.
Не сжижается
при обычной температуре.
Tпл. = -220°С, Tкип. = -188°С
Слайд 13
галогены
Хлор –
желто-зеленый газ,
с резким удушливым запахом.
Сжижается при
обычной температуре под давлением.
Tпл. = -101°С, Tкип. =
-34°С
Растворяется в воде,
образуя желтоватую хлорную воду
Слайд 14
галогены
Бром –
буровато-коричневая жидкость
с резким, зловонным запахом
Tпл. =
-7°С, Tкип. = +58°С
Растворяется в воде,
образуя коричневатую бромную
воду
Слайд 15
галогены
Йод –
черно-фиолетовое твердое вещество с металлическим блеском
Запах
резкий
Tпл. = +114°С, Tкип. = +186°С
Плохо растворим в воде,
хорошо растворяется в органических растворителях (спирте)
Слайд 16
галогены
галогены
галогены
галогены
Получение
Слайд 17
галогены
2КMnO4 + 16HCl = 5Cl2 + 2MnCl2 +
2KCl + 8H2O
Получение хлора в лаборатории
Слайд 18
галогены
Химическая активность галогенов как неметаллов
от фтора к
йоду ослабевает
галогены
галогены
галогены
Слайд 19
галогены
галогены
галогены
галогены
Кристаллики сурьмы в колбе с хлором, красиво вспыхивают
и сгорают, образуя смесь двух хлоридов сурьмы (III и
V)
Слайд 20
галогены
галогены
галогены
галогены
Кристаллики сурьмы в колбе с хлором, красиво вспыхивают
и сгорают, образуя смесь двух хлоридов сурьмы (III и
V)
2Sb + 3Cl2 = 2SbCl3
2Sb + 5Cl2 = 2SbCl5
Слайд 21
галогены
В парах хлора сгорает раскаленная медная проволока, образуя
хлорид меди (II)
Слайд 22
галогены
В парах хлора сгорает раскаленная медная проволока, образуя
хлорид меди (II)
Cu + Cl2 = CuCl2
Слайд 23
галогены
Горение красного фосфора в хлоре
Слайд 24
галогены
Горение красного фосфора в хлоре
2P + 5Cl2 =2PCl5
Слайд 25
галогены
Горение парафиновой свечи в хлоре
Слайд 26
галогены
Поглощение брома активированным углем
Слайд 27
галогены
Хлор реагирует с водой на холоде с образованием
соляной и хлорноватистой кислот.
Cl2 + Н2О ⇄ HCl +
НОСl
Слайд 28
галогены
Вода горит в струе фтора
Слайд 29
галогены
Вода горит в струе фтора
2Н2О + 2F2 =
4HF + О2
Слайд 30
галогены
Фтор –
Энергично реагирует со всеми простыми веществами (за
исключением О2, N2, Не, Ne,
Ar) с образованием фторидов.
Реагирует со всеми металлами при обычных условиях, а при нагревании и с золотом, серебром, платиной.
Криптон взаимодействует с фтором под действием электрического разряда.
Ксенон горит в атмосфере фтора ярким пламенем.
В атмосфере фтора горят даже негорючие асбест и вода.
В соединении с фтором элементы часто проявляют высшие степени окисления.
Н2 + F2 = 2HF 2Н2О + 2F2 = 4HF + О2
Zn + F2 = ZnF2
2NH3 +3 F2 = 6HF + N2 (при высокой температуре)
Слайд 31
галогены
Хлор –
Непосредственно реагирует с металлами и неметаллами в
основном при нагревании:
2Na + Cl2 = 2NaCl
2P + 3Cl2
= 2PCl3
2P + 5Cl2 = 2PCl5 (с избытком хлора)
H2 + Cl2= 2HCl
(при обычных условиях реакция идет медленно, при нагревании или освещении происходит взрыв)
Не соединяется непосредственно с углеродом, азотом, кислородом
С серой образует на холоде дихлорид дисеры
2S + Cl2 = S2Cl2
Вытесняет бром и йод из растворов их солей:
Сl2 + 2NaBr = 2NaCl + Br2
Слайд 32
галогены
Бром –
Непосредственно реагирует со многими элементами, наиболее
энергично – с алюминием:
2Аl + 3Вr2= 2АlBr3
В парах брома
сгорает раскаленная медная проволока:
Сu + Вr2 = СuBr2
Реакция с водородом идет медленно:
Н2 + Вr2 ⇄ 2НВr
Свободный бром вытесняет йод из солей:
Br2 + 2KI = 2KBr + I2
Слайд 33
галогены
Йод –
С крахмалом йод дает соединение ярко
синего цвета, его образование является качественной реакцией на йод
Йод
способен при нагревании и нормальном давлении переходить в газообразное состояние, минуя жидкую фазу. Этот процесс называется возгонкой.
Окисляет металлы медленнее, но в присутствии воды (как катализатора) реакция протекает очень бурно
2Al + 3I2 = 2AlI3
Реакция с водородом слабо эндотермическая, протекает медленно даже при нагревании.
Н2 + I2 = 2Нl