Слайд 2
Основные термины, понятия.
Растворы
гидраты
кристаллогидраты, растворимость ненасыщенные растворы
насыщенные растворы
перенасыщенные растворы
Электролиты сильные электролиты слабые электролиты неэлектролиты ионы катионы
анионы реакции ионного обмена реакции нейтрализации электролитическая диссоциация ассоциация степень электролитической диссоциации.
Кислоты классификация и химические свойства кислот
Основания классификация и химические свойства оснований
Оксиды классификация и химические свойства оксидов
Соли классификация и химические свойства солей,
генетическая связь классов неорганических соединений генетические ряды металлов и неметаллов
окислительно - восстановительные реакции
окислитель восстановитель
процесс окисления процесс восстановления
метод электронного баланса.
Слайд 3
Блок теоретического материала.
Задание 1: Впиши термин, составляя последовательную
цепочку из их названий.
(5 мин.)
Задание 2: Дополни
алгоритм, вписав недостающие действия.
(3 мин.)
Слайд 4
Ответы блока теоретических знаний. Вариант1.
Схема ответа 1: раствор,
растворенное вещество, катионы, электоролитическая диссоциация, ионы, кислоты, анионы, ионные
реакции, щелочи, окисление.
Ответ 2: возникающие силы взаимного притяжения ослабляют связь между ионами в кристалле электролита.
Слайд 5
Ответы блока теоретических знаний. Вариант 2.
Схема ответа 1:
гидраты, раствор, анионы, степень электролитической диссоциации, ионы, соли, катионы,
ассоциация, амфотерные оксиды, восстановление.
Ответ 2: составляем уравнение ионного обмена в общем, полном ионном виде.
Слайд 6
Ответы блока теоретических знаний. Вариант 3.
Схема ответа 1:
кристаллогидрат, диполь, катионы водорода, гидроксид-анионы, электоролитическая диссоциация, ионы, кислоты,
анионы, ионные реакции, катионы металла и анионы кислотного остатка, основания, образование осадка, выделение газа, образование воды.
Ответ 2: Составляем молекулярное уравнение реакции с учетом коэффициентов из электронных уравнений.
Слайд 7
Блок решения упражнений. Кислоты
Кислоты – это сложные вещества,
молекулы которых состоят из атомов водорода и кислотного остатка.
Кислоты
– это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка.
Классификация
по составу – бескислородные и кислородсодержащие;
по основности – одно-, двух-, трехосновные;
по растворимости в воде – растворимые и нерастворимые;
по силе - сильные и слабые электролиты;
по стабильности – стабильные и нестабильные:
по летучести – летучие и нелетучие.
Слайд 8
Блок решения упражнений. Кислоты
Основные химические свойства:
кислота + щелочь = соль
+ вода (реакция обмена, нейтрализации)
кислота + нерастворимое основание = соль + вода (реакция обмена)
кислота + основной оксид = соль + вода (реакция обмена)
кислота + соль слабой кислоты = новая соль + новая кислота (реакция обмена)
кислота + металл , стоящий в ряду напряжений металлов до водорода = соль + водород (реакция замещения)
Слайд 9
Блок решения упражнений. Основания
Основания – это сложные вещества,
молекулы которых состоят из атомов металла и одной или
нескольких гидроксогрупп.
Растворимые основания – это электролиты, которые при диссоциации образуют катионы металла и гидроксид - анионы.
Классификация по кислотности – одно-, двух-, трехкислотные; по растворимости в воде – растворимые и нерастворимые; по силе - сильные и слабые электролиты; по стабильности – стабильные и нестабильные: по летучести – летучие и нелетучие.
Слайд 10
Блок решения упражнений. Основания.
Основные
химические свойства:
щелочь + кислота = соль + вода (реакция
обмена, нейтрализации)
нерастворимое основание + кислота = соль + вода (реакция обмена)
растворимое основание + кислотный оксид = соль + вода (реакция обмена)
растворимое основание + растворимая соль = новая соль + новое основание (реакция обмена)
нерастворимое основание = оксид металла + вода (реакция разложения)
Слайд 11
Блок решения упражнений. Соли.
Соли – это сложные вещества,
молекулы которых состоят из атомов металла и кислотного остатка.
Растворимые соли – это электролиты, которые при диссоциации образуют катионы металла (или аммония) и анионы кислотного остатка.
Классификация по составу – кислые, средние, основные; по растворимости в воде – растворимые, малорастворимые и нерастворимые; по силе – все растворимые соли - сильные электролиты.
Слайд 12
Блок решения упражнений. Соли.
Основные химические свойства:
соль + щелочь
= новая соль + новое основание (реакция обмена)
растворимая соль
+ металл = новая соль + новый металл (реакция замещения)
соль слабой кислоты + кислота = новая соль + новая кислота (реакция обмена)
соль + соль = новая соль + новая соль (реакция обмена)
неМе -> оксид неMe -> соль -> кислота -> кислотный оксид -> неМе
Si -> SiO2 -> Na2SiO3 -> H2SiO3 -> SiO2 -> Si
Слайд 13
Генетические ряды
металлов и неметаллов
Ме ->оксид Me ->
гидроксид Ме -> соль
Li -> Li2O
-> LiOH -> LiCl
неМе -> оксид неMe (кислотный оксид) -> гидроксид неМе (кислота) -> соль
P -> P2O5 -> H3PO4 -> Na3PO4
неМе -> оксид неMe -> соль -> кислота -> кислотный оксид -> неМе
Si -> SiO2 -> Na2SiO3 -> H2SiO3 -> SiO2 -> Si
Слайд 14
Характеристика веществ по признакам классификации
Ba(OН)2 – гидроксид бария:
двукислотное, растворимое в воде, стабильное, нелетучее основание.
Cu(OН)2 – гидроксид
меди (II): двукислотное, нерастворимое в воде, нестабильное (разлагается при нагревании), нелетучее основание.
Н2S – сероводородная кислота: бескислородная, двуосновная, малорастворимая в воде, стабильная, летучая, слабый электролит(диссоциирует ступенчато)
Н2S -> H+ + HS¯
HS¯-> H+ + S2-
Слайд 15
Алгоритм
расчетной задачи по химии
Внимательно прочитайте условие задачи.
Слева,
запишите слово «Дано», а под ним кратко данные задачи
и что необходимо найти.
Правее запишите слово «Решение», и производите все остальные записи и расчёты под ним:
а)
запишите уравнение реакции, если данная задача подразумевает какое-либо химическое взаимодействие;
в уравнении одной чертой подчёркните химические формулы веществ, данные которых (m, V, ) указаны в условиях задачи, а двумя чертами – формулы тех веществ, данные которых требуется вычислить;
по уравнению реакции определите: количество (моль) тех веществ, формулы которых подчёркнуты (одной или двумя чертами). Коэффициент, стоящий перед формулами подчёркнутых (в данном случае) веществ, будет показывать количества данных веществ (): Mr , M, V, Vm;
найденные значения запишите под соответствующими химическими формулами;
б) запишите расчётные формулы, необходимые для решения данной задачи;
в) произведите расчёты;
4. Запишите ответ.
Слайд 16
Алгоритм решения задачи
по химическому уравнению
Внимательно прочитайте условие
задачи и сделайте краткую запись: что дано? следует найти?
Если
вещества даны с примесями, то сначала вычислите массу чистого вещества, содержащегося в примеси.
Составьте уравнение соответствующей химической реакции.
В уравнении одной чертой подчёркните химические формулы веществ, данные которых (m, V, ) указаны в условиях задачи, а двумя чертами – формулы тех веществ, данные которых требуется вычислить.
По уравнению реакции определите: количество (моль) тех веществ, формулы которых подчёркнуты (одной или двумя чертами). Коэффициент, стоящий перед формулами подчёркнутых (в данном случае) веществ, будет показывать количества данных веществ (): Mr , M, V, Vm .
Найденные значения запишите под соответствующими химическими формулами и произведите вычисления (составив пропорцию).
Запишите ответ.
Слайд 17
Алгоритм
вычисления количества вещества продукта реакции по массовой доле
исходного вещества в растворе.
Запишите краткое условие задачи и уравнение
химической реакции, подчеркните вещества, о которых идет речь в задаче.
II -1. Пользуясь формулой mвещ. = mраствора * ω, рассчитайте массу чистого вещества.
II – 2. Проанализируйте условие задачи и уравнение.
III. Сделайте необходимые расчеты.
Слайд 18
Алгоритм выражения
концентрации растворенного вещества.
Помните: 1) концентрация
раствора – это содержание растворенного вещества
в заданном количестве раствора;
2) она показывает долю вещества в растворе;
3) концентрация выражается в долях от единицы, процентах, количестве вещества в определенном объеме раствора.
4) растворы, в которых доля растворенного вещества более 30%, называются концентрированными;
5) растворы, в которых доля растворенного вещества менее 30%, называются разбавленными;
Слайд 19
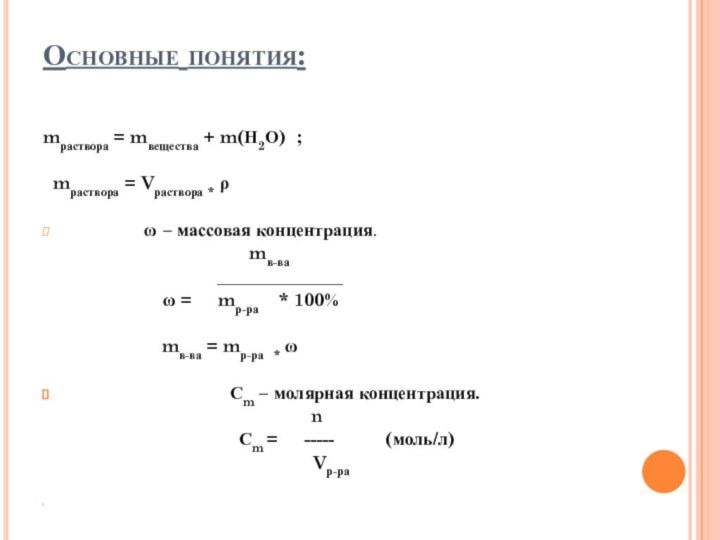
Основные понятия:
mраствора = mвещества + m(Н2О) ;
mраствора = Vраствора * ρ
ω – массовая концентрация.
mв-ва
______________
ω = mр-ра * 100%
mв-ва = mр-ра * ω
Сm – молярная концентрация.
n
Сm = ----- (моль/л)
Vр-ра
Слайд 20
I. Массовая процентная концентрация.
Массовая концентрация – это количество
растворенного вещества (в г), содержащееся в 100 г раствора.
Определение
массовой доли.
Дано:
ω = mв-ва m(Н2О) = 200 г
mр-ра mв-ва = 50 г
ω = ?
Решение:
ω = 50 : (200 + 50) = 0,2 (20%)
Слайд 22
выполнено 40-60% объема работы-
оценка«3»
выполнено 61-80% объема работы-
оценка«4»
выполнено 81-100% объема работы-
оценка «5»