- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Характеристика железа
Содержание
- 2. Сегодня на уроке мы с вами продолжаем изучать металлы. Какие металлы мы уже рассмотрели?
- 3. Сегодня рассматриваем очень важный металл –
- 4. Ответь на загадку:Пахать и строить, все он может, если ему уголек в том поможет
- 5. Урок на тему:Железо, его строение, физические и химические свойства.
- 6. Цель урока:1. Рассмотреть положение железа в ПСХЭ,
- 7. Железо Железо не только основа всего мира,
- 8. Строение атома железа Задание: прочитайте текст учебника
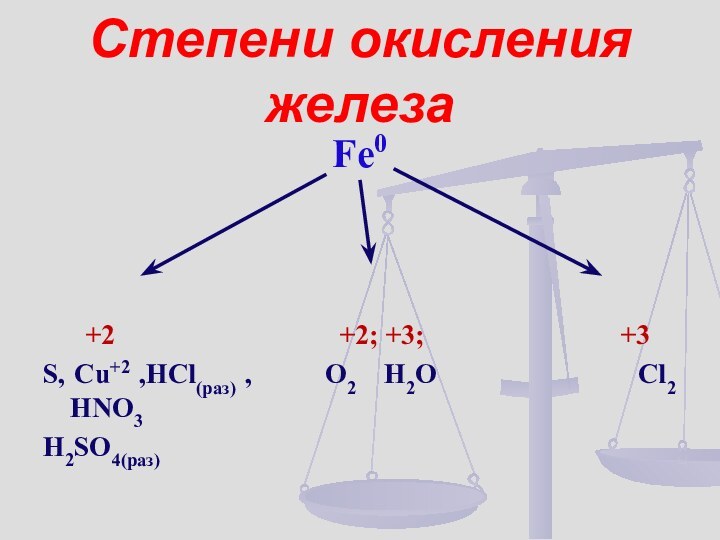
- 9. Степени окисления железаFe0 +2
- 10. Нахождение в природеХалькопирит(CuFeS2) с включениями кварцаПирит
- 11. Нахождение в природеFe Магнитный железнякмагнетит Fe3O4 Красный
- 12. ПрименениеМагнитный, красный, бурый железняки –для производства черной
- 13. Физические свойстваЖелезо - сравнительно мягкий, ковкий, серебристо-серый
- 14. Химические свойства железа1. Железо реагирует с неметаллами:Fe
- 15. Химические свойства железа 2. Железо реагирует с
- 16. Химические свойства железа3. Реагирует с растворами солей
- 17. Химические свойстваПрочитайте текст учебника, составьте уравнения реакций
- 18. Биологическая роль железаЖелезо играет важную роль в
- 19. Если интересно…www.catalogmineralov.ru – сайт содержит каталог минералов,
- 20. Домашнее задание§14, страница 76 – 78, до
- 21. Давайте с вами вспомним, какие степени окисления характерны для железа?
- 22. На основании этого можно сказать, что
- 23. Урок на тему:Генетические ряды железа (II) и железа (III). Важнейшие соли железа
- 24. Цель урока:1. Повторить строение атома железа, его
- 25. Задание Записать в тетрадь генетический ряд соединений
- 26. Вывод: Соединения железа (II) проявляют основные свойства. FeO и Fe(OH)2 – сильные восстановители
- 27. ЗаданиеЗаписать в тетрадь генетический ряд соединений железа
- 28. Вывод: Соединения железа (III) проявляют амфотерные свойства Fe2O3 и Fe(OH)3 – слабые восстановители и слабые окислители
- 29. Качественные реакции на ионы железаНа ион Fe+2
- 30. Качественные реакции на ионы железаK3[Fe(CN)6]—красная кровяная сольK4[Fe(CN)6]–
- 31. Скачать презентацию
- 32. Похожие презентации
Сегодня на уроке мы с вами продолжаем изучать металлы. Какие металлы мы уже рассмотрели?

























![Характеристика железа Качественные реакции на ионы железаK3[Fe(CN)6]—красная кровяная сольK4[Fe(CN)6]– желтая кровяная сольFeCl2+ K3[Fe(CN)6 =](/img/tmb/11/1082256/5b23f8796a784ea43570fbfcb607aab6-720x.jpg)

Слайд 3 Сегодня рассматриваем очень важный металл – основу
современной техники и сельскохозяйственного машиностроения, транспорта и средств связи,
космических кораблей и, вообще, всей современной цивилизации
Слайд 6
Цель урока:
1. Рассмотреть положение железа в ПСХЭ, его
строение атома.
2. Узнать, в каких соединениях железо встречается
в природе.3. Познакомиться с физическими и химическими свойствами железа.
4. Вспомнить, какое значение имеет железо для человека.
Слайд 7
Железо
Железо не только основа всего мира, самый
главный металл окружающей нас природы, оно – основа культуры
и промышленности, оно – орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлым, настоящим и будущими судьбами человечества.А. Е. Ферсман.
Слайд 8
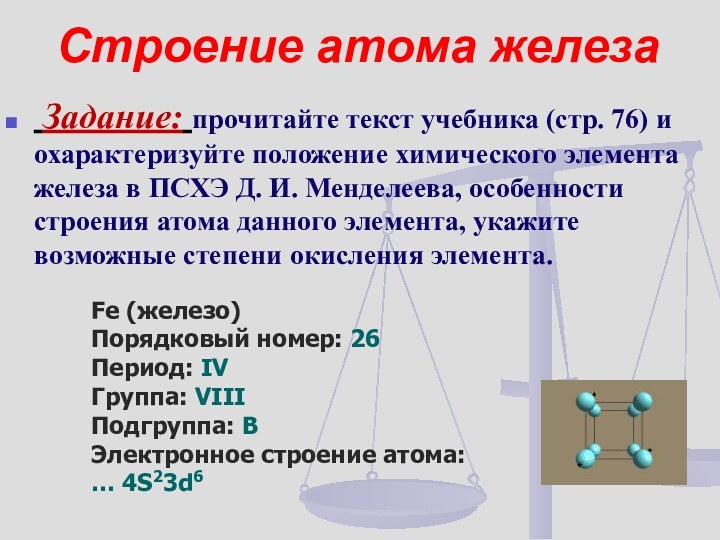
Строение атома железа
Задание: прочитайте текст учебника (стр.
76) и охарактеризуйте положение химического элемента железа в ПСХЭ
Д. И. Менделеева, особенности строения атома данного элемента, укажите возможные степени окисления элемента.Fe (железо)
Порядковый номер: 26
Период: IV
Группа: VIII
Подгруппа: В
Электронное строение атома:
… 4S23d6
Слайд 11
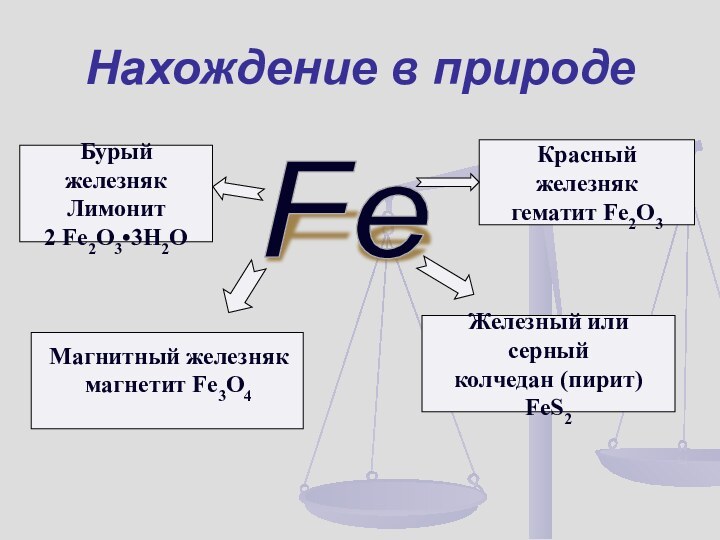
Нахождение в природе
Fe
Магнитный железняк
магнетит Fe3O4
Красный железняк
гематит
Fe2O3
Бурый железняк
Лимонит
2 Fe2O3•3H2O
Железный или серный
колчедан (пирит)
FeS2
Слайд 12
Применение
Магнитный, красный, бурый железняки –для производства черной металлургии
(чугуна и стали).
Железный колчедан – для производства серной кислоты.
Железный
купорос– для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины. Соединение железа издавна применяют для лечения малокровия, при истощении, упадке сил.
Чугун и сталь в технике и в быту.
Хлорид железа(lll) – при очистке воды, в качестве протравы при крашении тканей.
Сульфат железа(lll) - при очистке воды, в качестве растворителя в гидрометаллургии .
Слайд 13
Физические свойства
Железо - сравнительно мягкий, ковкий, серебристо-серый металл.
Температура
плавления – 1535 0С
Температура кипения около 2800 0С
При температуре
ниже 770 0С железо обладает ферромагнитными свойствами (оно легко намагничивается, и из него можно изготовить магнит).
Выше этой температуры ферромагнитные свойства железа исчезают, железо «размагничивается».
Слайд 14
Химические свойства железа
1. Железо реагирует с неметаллами:
Fe +
S = FeS
При нагревании до 200-250 0С реагирует с
хлоромFe+Cl2=FeCl3
Задание: Расставьте коэффициенты в уравнении реакции методом электронного баланса, укажите окислитель, восстановитель, процессы окисления и восстановления
Fe0 - 3e = Fe+3
Cl02+2e=2Cl-1
2 – восстановитель, процесс окисления
3 – окислитель, процесс восстановления
Проверь себя !
Слайд 15
Химические свойства железа
2. Железо реагирует с кислотами:
Fe+H2SO4=FeSO4+H2↑
В концентрированных азотной и серной кислотах железо не растворяется,
так как на поверхности металла возникает пленка, препятствующая реакции металла с кислотой( происходит пассивация металла)
Задание: Расставьте коэффициенты в уравнении реакции
Fe + HCl FeCl2 + H2↑ методом электронного баланса, укажите окислитель, восстановитель, процессы окисления и восстановления
Слайд 16
Химические свойства железа
3. Реагирует с растворами солей металла
согласно электрохимическому ряду напряжений металлов:
Fe + CuSO4 =
Fe SO4 + CuЗадание: Расставьте коэффициенты в уравнении реакции методом электронного баланса, укажите окислитель, восстановитель, процессы окисления и восстановления.
Слайд 17
Химические свойства
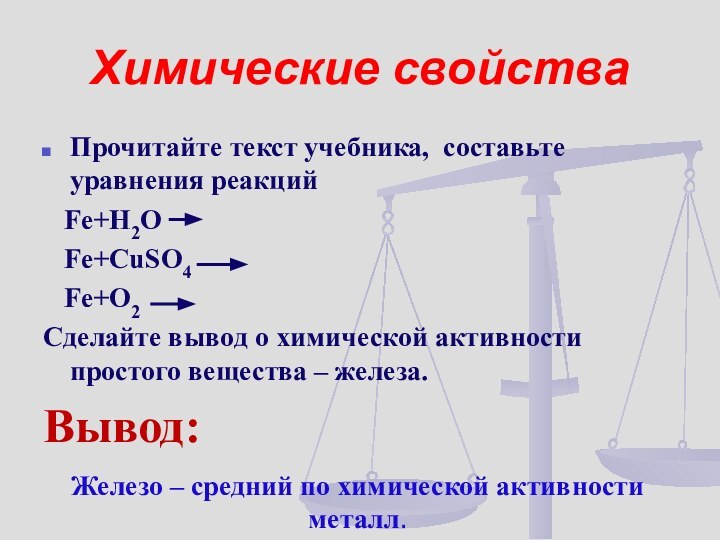
Прочитайте текст учебника, составьте уравнения реакций
Fe+H2О
Fe+CuSO4
Fe+O2
Сделайте вывод о химической
активности простого вещества – железа.Вывод:
Железо – средний по химической активности металл.
Слайд 18
Биологическая роль железа
Железо играет важную роль в жизнедеятельности
живых организмов.
Оно входит в состав гемоглобина крови, соединения железа
применяютдля лечения малокровия, истощении, упадке сил.
Основным источником железа для человека является пища. Его много
в зеленых овощах, мясе, сухофруктах, шоколаде.
Fe
Слайд 19
Если интересно…
www.catalogmineralov.ru – сайт содержит каталог минералов, большую
коллекцию фотографий и описание минералов.
http://.elementy.ru – сайт « Элементы
большой науки», содержит каталоги и статьи научно-популярных журналов «Химия и жизнь», « Наука и жизнь», «Природа» и др.http://www.ovitanah.com - сайт посвящен витаминам и микроэлементам, содержит интересную информацию.
http://alhimik.ru – сайт «Алхимик» содержит самую разнообразную информацию по химии.
Слайд 20
Домашнее задание
§14, страница 76 – 78, до соединений
железа (II) и железа (III)
Записи в тетради
№5, страница 82,
письменноСлайд 22 На основании этого можно сказать, что для
железа характерны соединения со степенью окисления +2 (валентность II)
и соединения со степенью окисления +3 (валентность III)
Слайд 24
Цель урока:
1. Повторить строение атома железа, его основные
соединения, встречающиеся в природе, физические и химические свойства.
2. Рассмотреть
важнейшие соединения железа (II) и (III).Ознакомиться с качественными реакциями на ионы железа (II) и (III).
Слайд 25
Задание
Записать в тетрадь генетический ряд соединений железа
(II) – страница 79, §14
Составить соответствующие уравнения реакций.
Сделать
вывод – какими свойствами обладают соединения железа (II)?
Слайд 26
Вывод:
Соединения железа (II) проявляют основные свойства.
FeO
и Fe(OH)2 – сильные восстановители
Слайд 27
Задание
Записать в тетрадь генетический ряд соединений железа (III)
– страница 79, §14
Составить соответствующие уравнения реакций.
Сделать вывод
– какими свойствами обладают соединения железа (III)?
Слайд 28
Вывод:
Соединения железа (III) проявляют амфотерные свойства
Fe2O3
и Fe(OH)3 – слабые восстановители и слабые окислители
Слайд 29
Качественные реакции на ионы железа
На ион Fe+2 –
красная кровяная соль:
K3[Fe(CN)6] – гексацианоферрат (III) калия
На
ион Fe+3 – желтая кровяная соль:K4[Fe(CN)6] – гексацианоферрат (II) калия
Оба этих реактива с ионом Fe+2 и с ионом Fe+3 дают синее окрашивание.
Слайд 30
Качественные реакции на ионы железа
K3[Fe(CN)6]—красная кровяная соль
K4[Fe(CN)6]– желтая
кровяная соль
FeCl2+ K3[Fe(CN)6 = KFe[Fe(CN)6]
турнбуллева синьFeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]
берлинская лазурь
KFe+2 [Fe+3 (CN)6] = KFe+3 [Fe+2 (CN)6]
Турнбуллева синь берлинская лазурь





























