Слайд 2
. Составьте химические формулы оснований для Fe
(II) и Cu(II), назовите их. Изменяют ли окраску индикаторов
эти вещества? Почему?
Для Fe (II) Fe(OH)2 – гидроксид железа (II)
Для Cu(II) Cu(OH)2 – гидроксид меди (II)
Окраску индикаторов не изменяют,
так как являются нерастворимыми основаниями.
Слайд 3
Выполните задания:
Из предложенного перечня веществ выпишите отдельно
формулы оксидов и оснований, в соответствии с известной вам
классификацией, и дайте им названия:
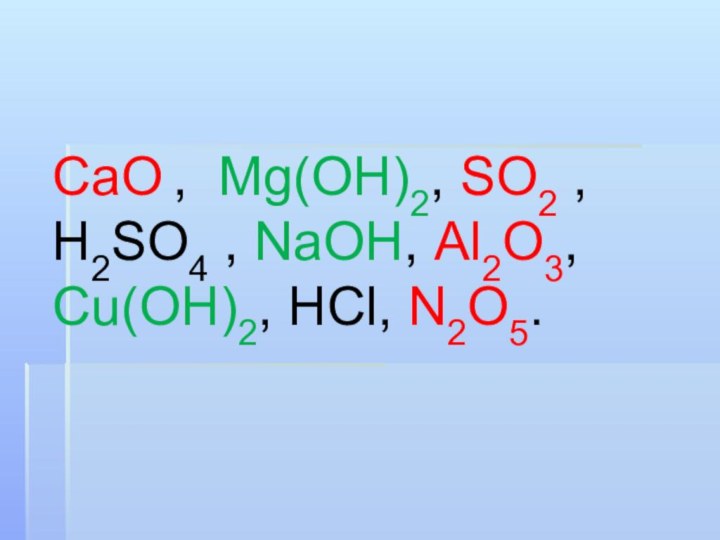
CaO , Mg(OH)2, SO2 , H2SO4 , NaOH, Al2O3, Cu(OH)2, HCl, N2O5.
Слайд 4
CaO , Mg(OH)2, SO2 , H2SO4 , NaOH,
Al2O3, Cu(OH)2, HCl, N2O5.
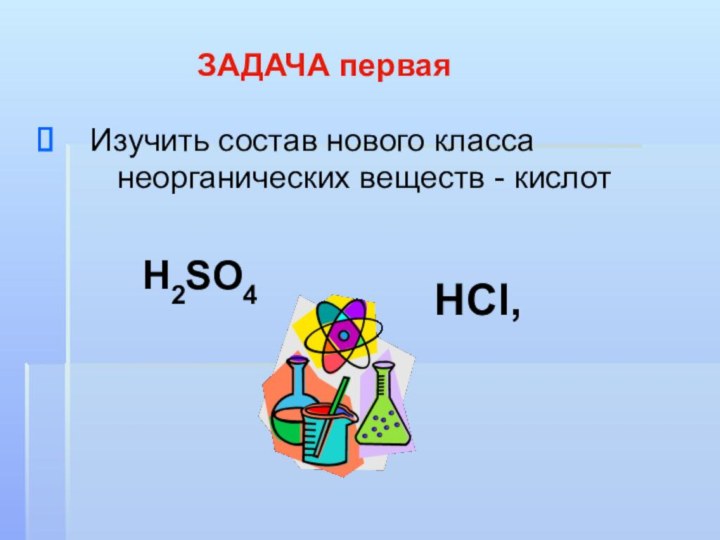
ЗАДАЧА первая
Изучить состав нового класса
неорганических веществ - кислот
H2SO4
HCl,
Слайд 7
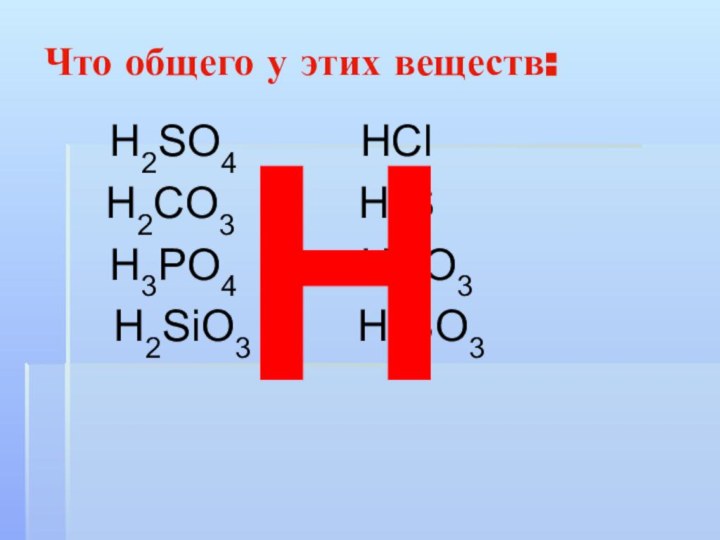
Что общего у этих веществ:
Н2SO4
НСl
Н2CO3 Н2S
Н3РO4 НNO3
Н2SiO3 Н2SO3
Н
Слайд 8
Что такое кислоты?
Сложные вещества, молекулы которых состоят
из атомов водорода и кислотного остатка
Слайд 9
ЗАДАЧА вторая
По каким признакам можно классифицировать
кислоты?
Слайд 10
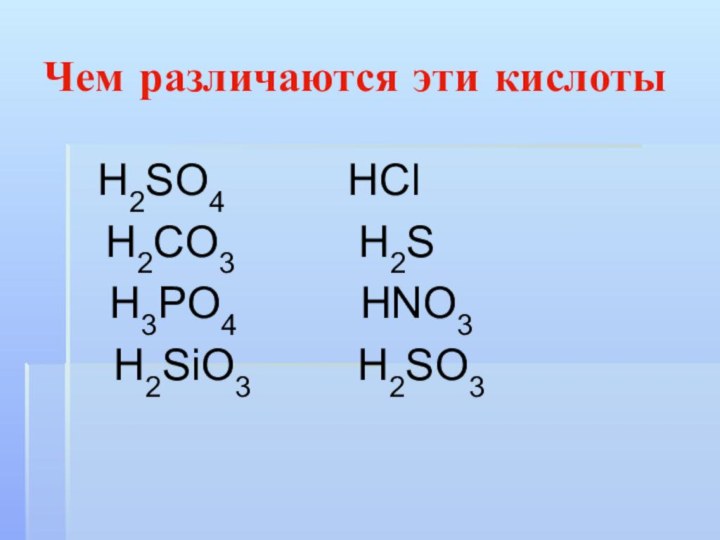
Чем различаются эти кислоты
Н2SO4
НСl
Н2CO3 Н2S
Н3РO4 НNO3
Н2SiO3 Н2SO3
Слайд 11
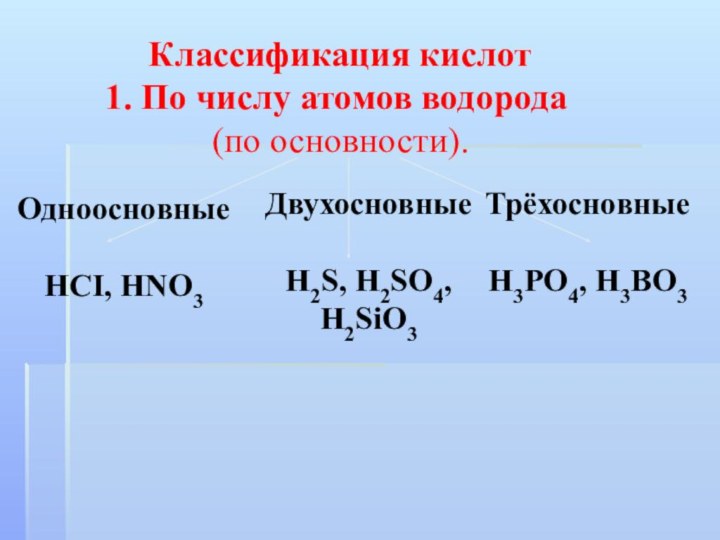
Классификация кислот
По числу атомов водорода
(по основности).
Одноосновные
HCI, HNO3
Трёхосновные
H3PO4, H3BO3
Двухосновные
H2S,
H2SO4, H2SiO3
Слайд 12
2. Кислоты по содержанию кислорода
Бескислородные
HBr, H2S, HCl
Кислородосодержащие
H2SO4,
H2CO3, HNO3
Слайд 13
ЗАДАЧА третья
Какие особенные свойства характерны для
кислот?
Слайд 14
Лабораторная работа
свойства кислот
Даны кислоты: HCl H2 SO4
CH3 COOH
Индикаторы:
лакмус, метиловый оранжевый
Ход работы:
Рассмотри выданные кислоты.
Налей кислоту в 2 пробирки (1см)
Добавь в каждую пробирку по 1-2 капли индикатора: в первую – лакмус
во вторую – метилоранж
Как изменился цвет индикатора.
Наблюдения запиши в тетрадь
Слайд 15
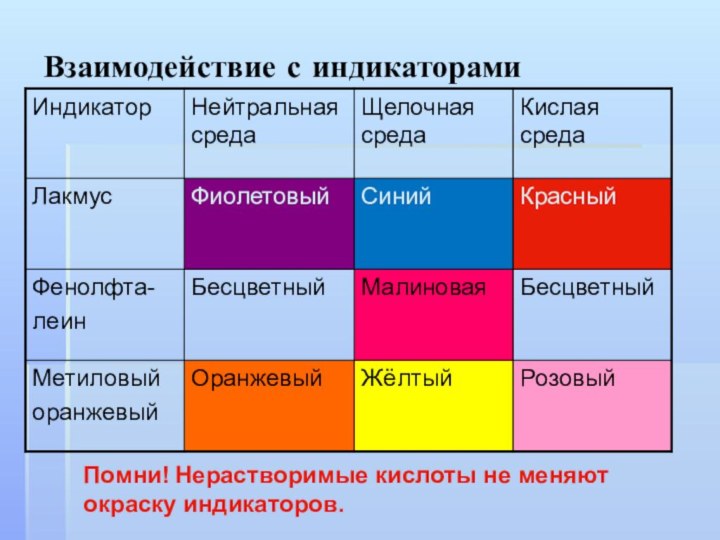
Взаимодействие с индикаторами
Помни! Нерастворимые кислоты не меняют окраску
индикаторов.
Слайд 16
Общие свойства кислот
1. Кислые на вкус
2. Изменяют окраску
индикаторов
Лакмус - Красный
Метиловый
Оранжевый Розовый
Слайд 17
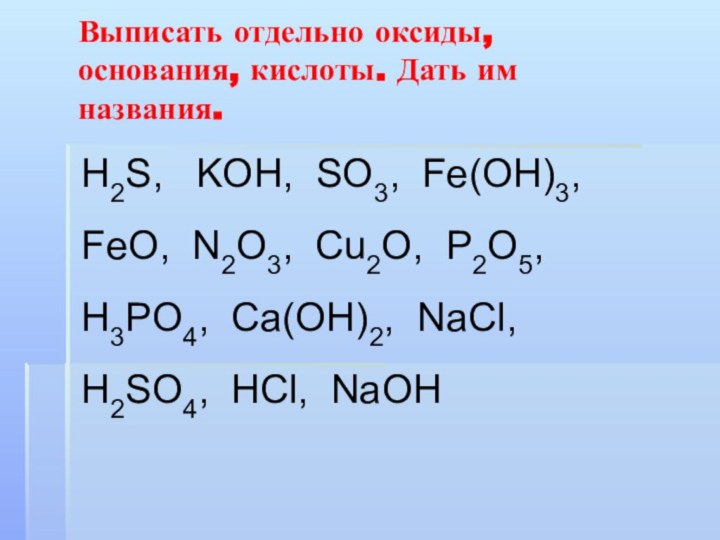
Выписать отдельно оксиды, основания, кислоты. Дать им названия.
H2S, KOH, SO3, Fe(OH)3, FeO, N2O3, Cu2O, P2O5,
H3PO4, Ca(OH)2, NaCl, H2SO4, HCl, NaOH
Слайд 18
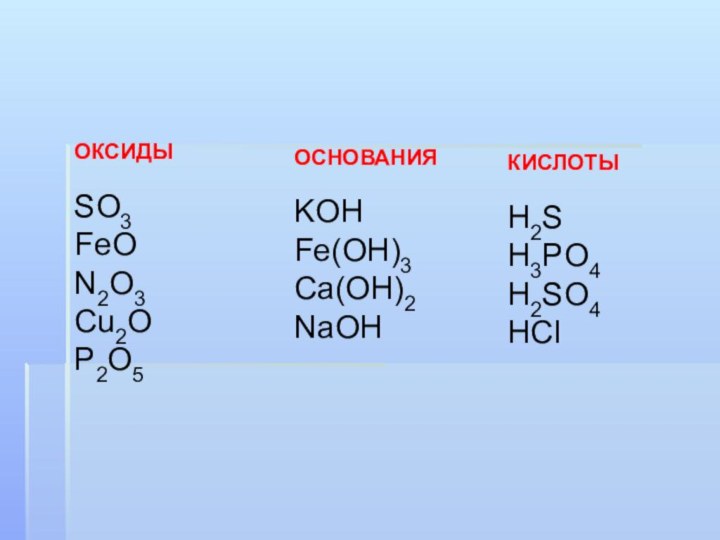
ОКСИДЫ
SO3
FeO
N2O3
Cu2O
P2O5
ОСНОВАНИЯ
KOH
Fe(OH)3
Ca(OH)2
NaOH
КИСЛОТЫ
H2S
H3PO4
H2SO4
HCl
Слайд 19
«Третий лишний»:
В каждой строчке найти
лишнюю формулу:
Н2S, Н2 SО4 , Н2SО3,
Н2СО3, Н3
РО4, Н2 SО4
Слайд 20
Домашнее задание
§ 20 (до с.104)
Выучить формулы
кислот
Задание по выбору:
- Подготовить сообщение :
1.
«Кислотные дожди»
2. «Кислоты в природе и их применение в быту»