- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Окислительно-восстановительные реакции. Электролиз.
Содержание
- 2. Степень окисления — это условный заряд атомов
- 3. Окислительно-восстановительные реакции — реакции, в ходе которых происходит изменение степеней окисления атомов.ABA0+0Be–+A* + B*-
- 4. Правила расчёта степеней окисленияСтепень окисления водорода в
- 5. Лабораторный способ получения водородаZn + 2HCl = Zn + 2Cl2 + H20+1 -1 +2 -1 00 +20ОкислительВосстановитель+1
- 6. Реакции горения углеводородов протекают с изменением степенейокисления атомов элементов.
- 7. Горение этана2С2Н6 + 7О2 → 4СО2 + 6Н2О-4-4 +4-2ОкислительВосстановитель0+1 0 +4 -2 +1 -2
- 8. Сильные восстановителиСильные окислителиводородуглеродсероводородаммиакметаллыкислородозонфторгалогенысерная кислотаазотная кислота
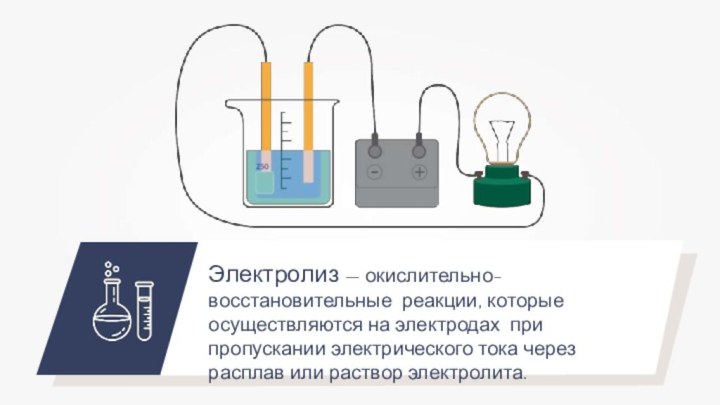
- 9. Электролиз — окислительно-восстановительные реакции, которые осуществляются на
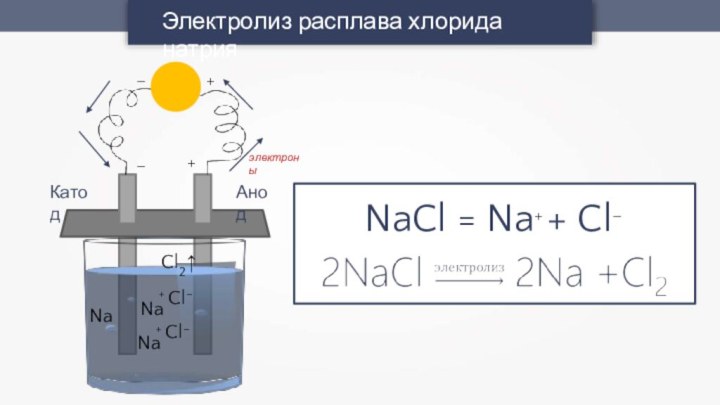
- 10. Электролиз расплава хлорида натрия+–+–АнодКатодCl2↑Na+ Cl–Na+ Cl–NaэлектроныNaCl = Na+ + Cl–
- 11. Диссоциация молекул воды при электролизерастворов→+ –Н2О →Н + ОH+–+–АнодКатодCl2↑Na+ Cl–NaNaэлектроныH+H++ Cl– OH–OH–
- 12. Электролиз раствора хлорида натрия----++++OHOHClNaNaClHHАнод Катод+ –2NaCl + 2H2O = 2NaOH + H2 + Cl2
- 13. Практическое промышленное применение электролиза
- 14. Практическое промышленное применение электролиза
- 15. Скачать презентацию
- 16. Похожие презентации
Степень окисления — это условный заряд атомов химического элемента в соединении, если предположить, что вещество состоит только из простых ионов.

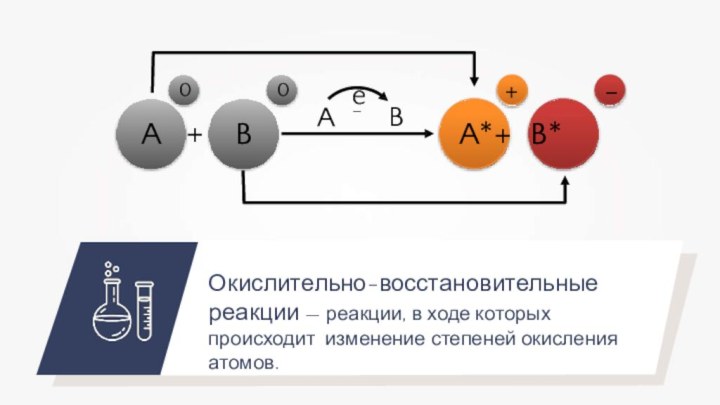








Слайд 3 Окислительно-восстановительные реакции — реакции, в ходе которых происходит
изменение степеней окисления атомов.
A
B
A
0
+
0
B
e–
+
A* + B*
-
Слайд 4
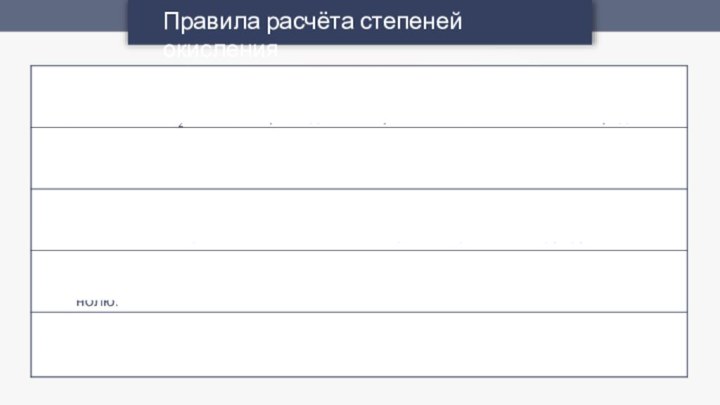
Правила расчёта степеней окисления
Степень окисления водорода в соединениях
равна +1
(исключения: гидриды, в которых степень окисления водорода -1).
Металлы
в соединениях всегда имеют положительную степень окисления, причём максимальная, как правило, равна номеру группы.
Степень окисления в простых веществах и свободных атомах всегда равна нолю.
В соединении сумма всех степеней окисления атомов элементов равна нолю.
Степень окисления кислорода в соединениях равна -2
+2
(исключения: OF2, а также пероксиды, в которых степень окисления кислорода -1).