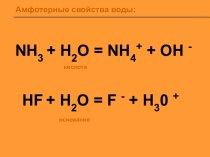- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии 9 класса Соли аммония , их свойства и применение
Содержание
- 2. Девизурока«Просто знать – еще не все,
- 3. Тема урока из двух слов: 1 слово-
- 4. « Исключения»:из ряда веществ исключить простые
- 5. Древний Египет храм Амона
- 6. Учебник стр.54- помоги себе сам!
- 7. Соли аммо́ния — соли, содержащиекатион аммония NH4+
- 8. Получение солей аммония Аммиак (или гидроксид аммония)
- 9. 1914 г. «Дым без огня»NH3+ HNO3→NH4NO3NH3 + HCl→NH4Cl2NH4OH+ H2 SO4→(NH4)2SO4+ H2O
- 10. Общие химические свойства 1. Сильные электролиты (диссоциируют
- 11. 3. C солями (реакция обмена):
- 12. Производство взрывчатыхвеществ
- 13. Разрыхлители тестаГидрокарбонат аммония NH4HCO3 и карбонат аммония
- 14. Минеральные удобрения
- 15. Для очищения при паянииХлорид аммония NH4Cl используют
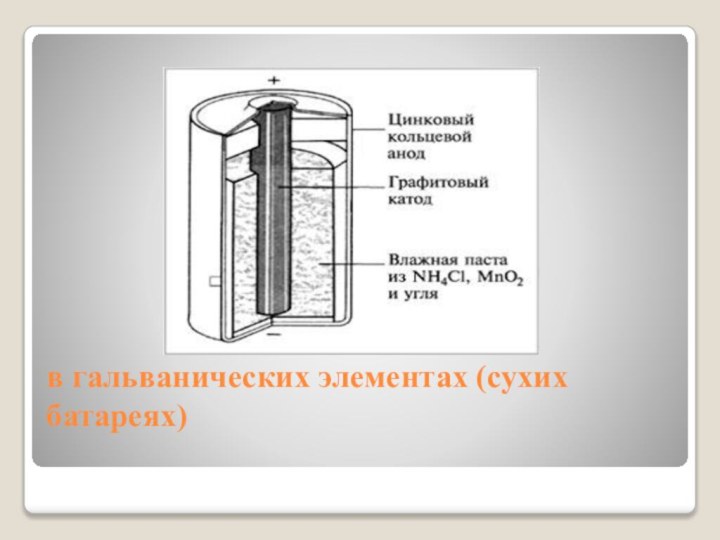
- 16. в гальванических элементах (сухих батареях)
- 17. При изготовлении дымовых шашек
- 18. Пищевые добавки Е510-
- 19. Допишите уравнения реакций1.NH4Cl+NaOH→…+…+H2O2.(NH4)2CO3+…→ H2O+CO2+ NH4Cl3.(NH4)2SO4+…→BaSO4+ NH4Cl4.NH4Cl→…+…
- 20. Задание 1 группе: В деревне у бабушки
- 21. Задания для закрепленияПредложите способ очистки поваренной соли
- 22. Скачать презентацию
- 23. Похожие презентации
Девизурока«Просто знать – еще не все, знания нужно уметь использовать» И.В.Гете




















Слайд 3
Тема урока из двух слов:
1 слово- вещество,
без которого не обходится ни один приём пищи;
из-за него в России были …бунты
Слайд 4
« Исключения»:из ряда веществ исключить простые вещества, оксиды
, кислоты, аммиак, нитрат натрия;
HNO3 ,N2 , NO2
, NH4NO3,N2O5, NH3 , NH4Cl , NaNO3
прочитайте оставшиеся формулы. Что у них общего? Как называется ион NH4? Предложите тему урока и цели.
Слайд 6
Учебник стр.54- помоги себе сам!
Выберите формулы
солей аммония и назовите их:NH4NO3 NH4Cl NaNO3 (NH4)3 PO4
CaCO3 (NH4) 2HPO4 NH4 H2PO4Из чего состоят соли аммония? Составьте их названия. Укажите заряды катионов и анионов.
Кислые и средние соли аммония
Слайд 7
Соли аммо́ния — соли, содержащие
катион аммония NH4+
и
анион кислотного остатка;
Все соли аммония растворимы в воде,
полностью диссоциируют в водном растворе.
Слайд 8
Получение солей аммония
Аммиак (или гидроксид аммония) +
кислота.
NH3 + HNO3 = NH4NO3
2NH4OH + H2SO4 =(NH4) 2SO4+
2Н2O
Слайд 10
Общие химические свойства
1. Сильные электролиты (диссоциируют в
водных растворах):
NH4Cl ↔ NH4 ++ Cl-2. С кислотами (реакция обмена):
(NH4) 2CO3 + 2НCl → 2NH 4Cl + Н2O + CO2 ↑
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2 ↑
CO32- + 2H+ → Н2O + CO2 ↑
Слайд 11
3. C солями (реакция обмена):
(NH4)2SO4
+ Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3
2NH4+ + SO42-
+ Ba2+ + 2NO3- → BaSO4 ↓ + 2NH4+ + 2NO3-Ba2+ + SO42- → BaSO4 ↓
4. При нагревании со щелочами выделяется аммиак (качественная реакция на ион аммония):
NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O
Слайд 13
Разрыхлители теста
Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3
применяют в кондитерском деле, так как они легко разлагаются
при нагревании и образуют газы, разрыхляющие тесто и делающие его пышным, например:NH4HCO3 = NH3↑ + Н2O↑ + CO2↑
Слайд 15
Для очищения при паянии
Хлорид аммония NH4Cl используют при
паянии, так как он очищает поверхность металла от оксидной
плёнки и к ней хорошо пристаёт припой.
Слайд 18
Пищевые добавки
Е510-
хлорид аммония в хлебобулочном производстве
, в пивоварении .В ряде стран запрещено
В России добавляют в дрожжи ,приправы, соусы, мучные изделия.
Е517- сульфат аммония- заменитель соли. Улучшает качество муки .
Разрешено в России и странах Евросоюза.
Слайд 19
Допишите уравнения реакций
1.NH4Cl+NaOH→…+…
+H2O
2.(NH4)2CO3+…→ H2O+CO2+ NH4Cl
3.(NH4)2SO4+…→
BaSO4+ NH4Cl
4.NH4Cl→…+…
Слайд 20 Задание 1 группе: В деревне у бабушки в
пакетиках с минеральными удобрениями написано: суперфосфат, аммофос, сильвинит.
Как помочь
бабушке найти азотные удобрения? Составьте уравнение(Смешать с известью - запах аммиака)
Задание 2 группе: Почему в состав разрыхлителя для теста входят карбонат и гидрокарбонат аммония? Составьте уравнения.
Слайд 21
Задания для закрепления
Предложите способ очистки поваренной соли от
содержащейся в ней примеси хлорида аммония.
Объясните, можно ли смешивать
аммиачную селитру (нитрат аммония) с известью?Решить задачу стр 55 №2