- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии 9 класс
Содержание
- 2. Тема урока:
- 3. Задачи урока: обучающие: изучить состав и
- 4. Ожидаемые результаты урока:Знать:строение молекулы аммиака и иона
- 5. План урока1. Организационный момент (2 мин.)2.
- 6. Этапы урокаI. Организационный момент (2 мин.)Задача организационного
- 7. Этапы урокаII. Мотивационно – ориентировочный
- 8. NH3История обнаружения аммиака
- 9. Этапы урокаIII. Операционно – исполнительский этап (18мин.)Задача
- 10. Состав вещества+7 N ) )
- 11. Образование иона аммонияHNHH••Есть возможность образовать донорно –
- 12. Между молекулами аммиака образуются водородные связи:Водородная связь
- 13. Ц Физические свойстваТкип = -33,50С
- 14. Химические свойства Взаимодействие с кислотамиNН3+НСI
- 15. ПрименениеNH3Производство азотной кислоты.Производство азотных удобренийПроизводство взрывчатых веществВ холодильных установках.В медицине, в быту.Для паяния
- 16. Этапы урокаIV. Оценочно – рефлексивный этап (10
- 17. Проверка знаний. Решение задач:При синтезе аммиака
- 18. Проверка знаний. 4) Осуществите цепочку превращений:
- 19. Проверка знаний (самоконтроль) Ответить на вопросы: Дать
- 20. Домашнее задание:§25,упр. 1-5;2) индивидуальное опережающее задание;3) получение аммиака выучить самостоятельно.
- 21. Рефлексия (на выбор учителя)Ученики по кругу высказываются
- 22. Скачать презентацию
- 23. Похожие презентации
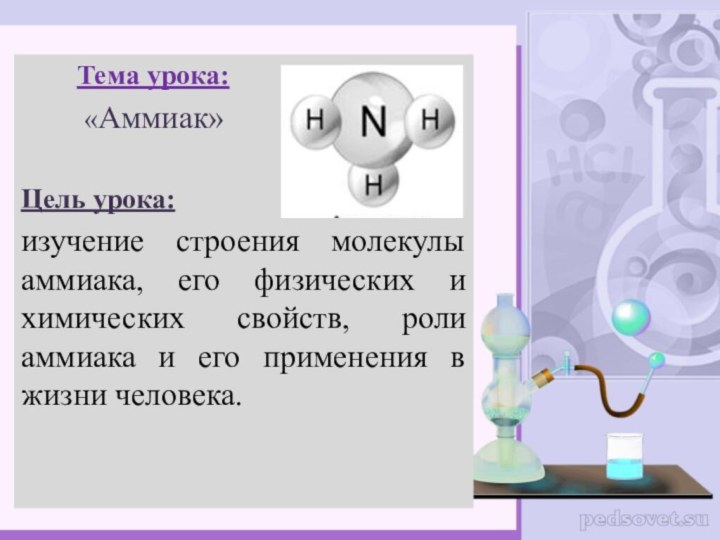
Тема урока: «Аммиак» Цель урока: изучение строения молекулы аммиака, его физических и химических свойств, роли аммиака и его применения в жизни человека.




















Слайд 2
Тема урока:
«Аммиак»
его физических и химических свойств, роли аммиака и его применения в жизни человека.
Слайд 3
Задачи урока:
обучающие: изучить состав и строение молекулы
аммиака, его физические и химические свойства; научить учащихся получать
аммиак в лабораторных условиях; дать представление о роли аммиака и его производных в жизни человека;развивающие: развивать умения работать с опорными конспектами, учебно – инструктивными картами, продолжить развитие умений и навыков проведения химического эксперимента, а также умения анализировать, сравнивать, обобщать, делать выводы, применять теоретические знания для объяснения различных явлений;
воспитательные: формировать бережное отношение к окружающей среде, чувства ответственности, уверенности и требовательности к себе, продолжить воспитание толерантности при работе в группе
Слайд 4
Ожидаемые результаты урока:
Знать:
строение молекулы аммиака и иона аммония;
механизм
образования связи по донорно-акцепторному механизму;
физические свойства аммиака;
особенности химических
реакций с аммиаком.Уметь:
составлять электронную, структурную формулы аммиака и иона аммония;
составлять уравнения химических реакций, характеризующие химические свойства и способы получения;
объяснять физиологическое воздействие аммиака на организм человека.
Слайд 5
План урока
1. Организационный момент (2 мин.)
2. Мотивационно
– ориентировочный этап: актуализация знаний, полученных на предыдущем уроке;
постановка целей урока (10 мин.)3. Операционно – исполнительский этап: способы получения аммиака, изучение физических и химических свойств аммиака, знакомство с солями аммония, области применения аммиака и его производных (18 мин.)
4. Оценочно – рефлексивный этап: контроль и самоконтроль: работа с тестами, с опорным конспектом, домашнее задание, рефлексия (10 мин.)
Слайд 6
Этапы урока
I. Организационный момент (2 мин.)
Задача организационного этапа:
приветствие
учащихся;
проверка готовности учащихся к уроку;
мотивация учащихся на решение
основной цели урока.
Слайд 7
Этапы урока
II. Мотивационно – ориентировочный
этап (10 мин.)
Задача данного этапа урока:
создание проблемной
ситуации через знакомство с древней историей происхождения аммиака;проверка домашнего задания через тестовые задания с целью выявления уровня подготовки учащихся к восприятию нового материала.
Слайд 9
Этапы урока
III. Операционно – исполнительский этап (18мин.)
Задача данного
этапа:
повышение уровня самостоятельно-познавательной работы учащихся для решения выделенной проблемы;
вовлечение
всех учащихся класса в работу по заполнению «Рабочей карты урока».
Слайд 11
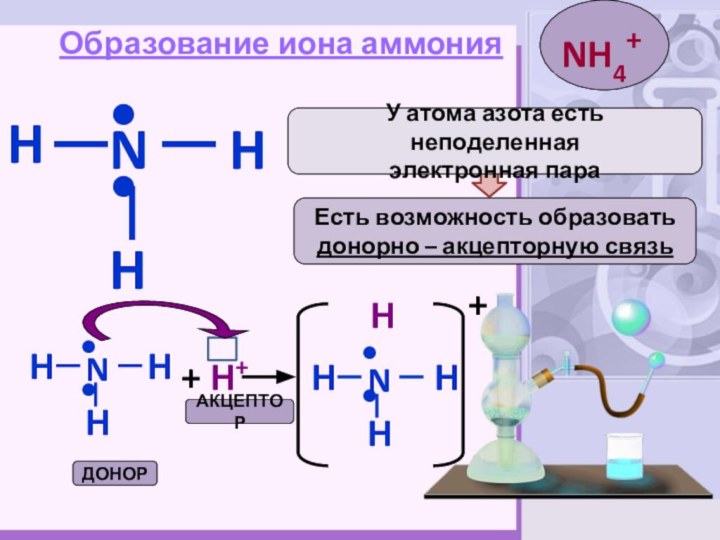
Образование иона аммония
H
N
H
H
••
Есть возможность образовать
донорно – акцепторную
связь
У атома азота есть неподеленная
электронная пара
N
H
H
H
••
+ H+
N
H
H
H
••
H+
АКЦЕПТОР
ДОНОР
Слайд 12
Между молекулами аммиака образуются водородные связи:
Водородная связь –
это связь между атомами очень электроотрицательного элемента (F, O,
N) одной молекулы и атомами водорода другой молекулы.δ-
Слайд 13
Ц
Физические свойства
Ткип = -33,50С
Тпл = -780С
3-10% р-р - нашатырный спирт
18-25% р-р - аммиачная вода
В 1 л Н2О 700 л NH3
легче воздуха
NH3
В
З - резкий
ЯД
Слайд 14
Химические свойства
Взаимодействие с кислотами
NН3+НСI
NН4 СI
NН3 +Н2 SО4 N Н4
НSО4 Взаимодействие с водой
NН3+НОН NН4 ОН
Аммиак горит в кислороде
4 NН3+3О2 2N2 + 6Н2О
NH3
Слайд 15
Применение
NH3
Производство азотной
кислоты.
Производство
азотных
удобрений
Производство
взрывчатых
веществ
В холодильных
установках.
В медицине,
в быту.
Для паяния
Слайд 16
Этапы урока
IV. Оценочно – рефлексивный этап (10 мин.)
Задача
данного этапа
решение (на выбор учащегося) заданий из материалов ЕГЭ
по химии прошлых лет с целью проверки/самопроверки усвоения материалов новой темы.
Слайд 17
Проверка знаний.
Решение задач:
При синтезе аммиака промышленным способом,
азот объёмом 50 л. (н.у.) прореагировал с водородом, взятом
в избытке. Выход продукта составил 50%. Рассчитайте объём и массу полученного аммиака.Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой?
Какой объём кислорода потребуется для сжигания 34 г. аммиака?
Слайд 18
Проверка знаний.
4) Осуществите цепочку превращений:
Азот
аммиак оксид азота
(II ) нитрат аммония аммиак азот5) Составьте уравнения следующих реакций и назовите продукты:
2NH3 + H2SO4 →
NH3 + H2SO4 →
NH3 + H3PO4 →
2NH3 + H3PO4 →
3NH3 + H3PO4 →
Слайд 19
Проверка знаний (самоконтроль)
Ответить на вопросы:
Дать характеристику азота
по положению в «Периодической системе элементов Д. И. Менделеева».
Какова модель атома азота?
Почему молекулярный азот химически инертен, а атомарный – химически активен?
Какова схема круговорота азота в природе?
Расскажите о двойственном названии элемента №7.
Кто и в каком году открыл азот?
Слайд 20
Домашнее задание:
§25,упр. 1-5;
2) индивидуальное опережающее
задание;
3)
получение аммиака выучить
самостоятельно.
Слайд 21
Рефлексия
(на выбор учителя)
Ученики по кругу высказываются одним предложением,
выбирая начало фразы из рефлексивного экрана на доске:
сегодня я
узнал… было интересно…было трудно… я понял, что…
теперь я могу… я научился…
у меня получилось … я смог…
меня удивило… урок дал мне для жизни…
мне захотелось…
II. Каждый ученик заполняют «Анкету»:
Пришел на урок ……. с радостью / со страхом
На уроке я работал …….. активно / пассивно
Своей работой на уроке я …… доволен / не доволен
Материал урока мне был ……. понятен / не понятен
……. полезен / бесполезен
…… интересен / скучен
……. легким / трудным
5. Настроение мое после урока ….. радостное / грустное
6. Оценка за урок себе …….. 1, 2, 3, 4, 5
своей группе …….. 1, 2, 3, 4, 5
классу …….. 1, 2, 3, 4, 5