- + + +
+ - - - - - +
+ + - -
- - + + + -
-
- + - +
+ + + - + -
+ +
- - - + - + - - - +
- + +
+
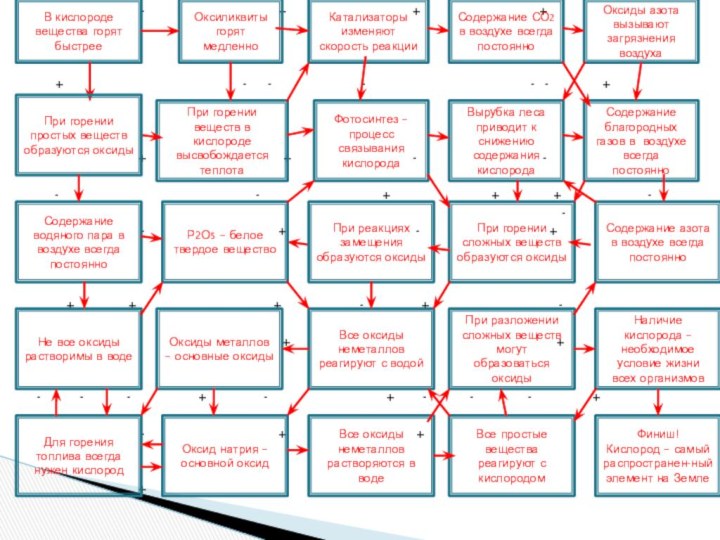
В кислороде вещества горят быстрее
Оксиликвиты горят
медленно
Катализаторы изменяют
скорость реакции
Содержание СО2 в воздухе всегда постоянно
Оксиды азота вызывают загрязнения воздуха
Содержание водяного пара в воздухе всегда постоянно
При горении веществ в кислороде высвобождается теплота
Фотосинтез – процесс связывания кислорода
Вырубка леса приводит к снижению содержания кислорода
Содержание благородных газов в воздухе всегда постоянно
При горении простых веществ образуются оксиды
Р2О5 – белое твердое вещество
При реакциях замещения образуются оксиды
При горении сложных веществ образуются оксиды
Содержание азота в воздухе всегда постоянно
Не все оксиды растворимы в воде
Оксиды металлов – основные оксиды
Все оксиды неметаллов реагируют с водой
При разложении сложных веществ могут образоваться оксиды
Наличие кислорода – необходимое условие жизни всех организмов
Для горения топлива всегда нужен кислород
Оксид натрия – основной оксид
Все оксиды неметаллов растворяются в воде
Все простые вещества реагируют с кислородом
Финиш!
Кислород – самый распространен-ный элемент на Земле