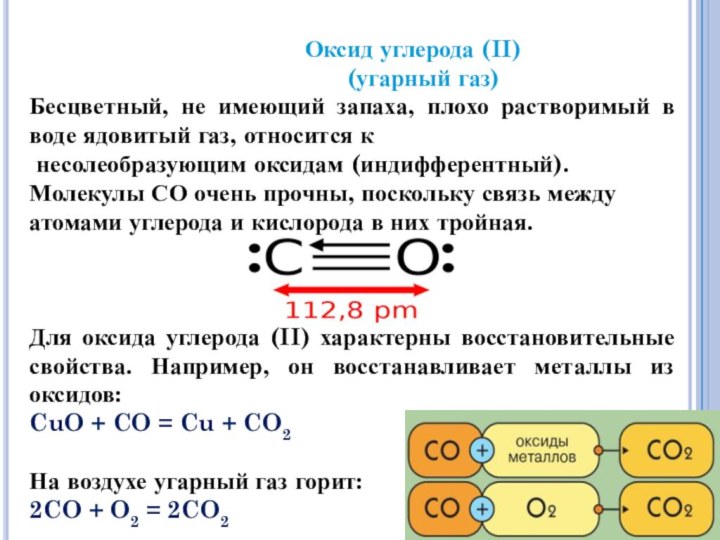
образует два оксида
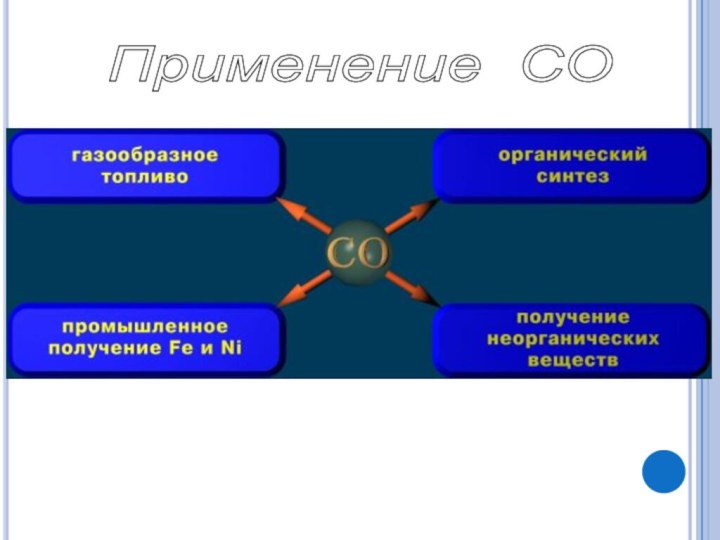
оксид углерода (II)
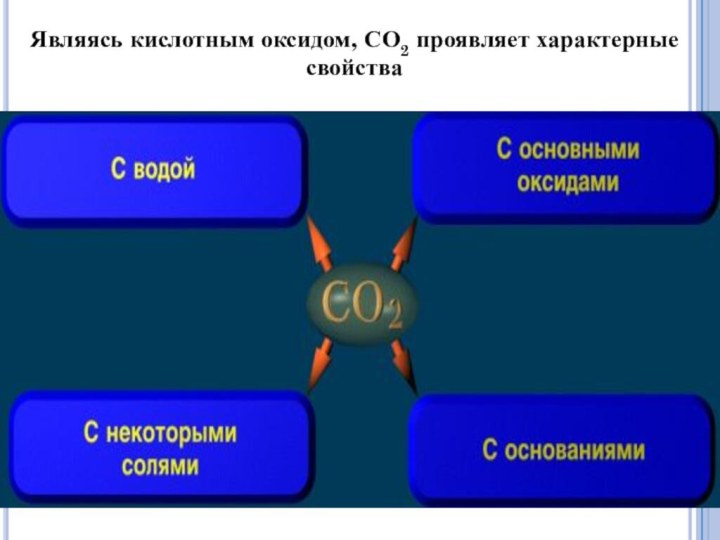
оксид углерода (IV)СО СО2
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



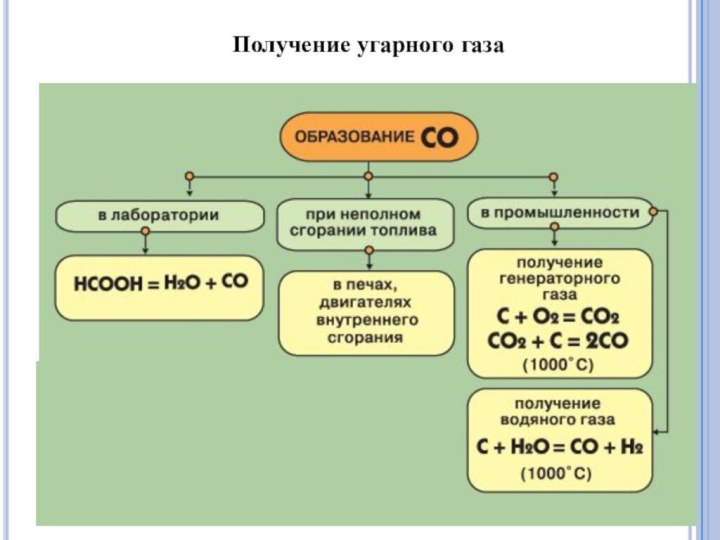

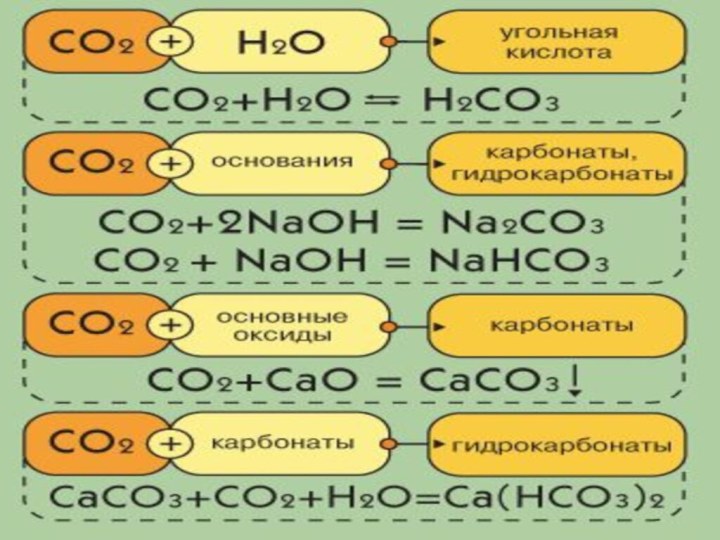
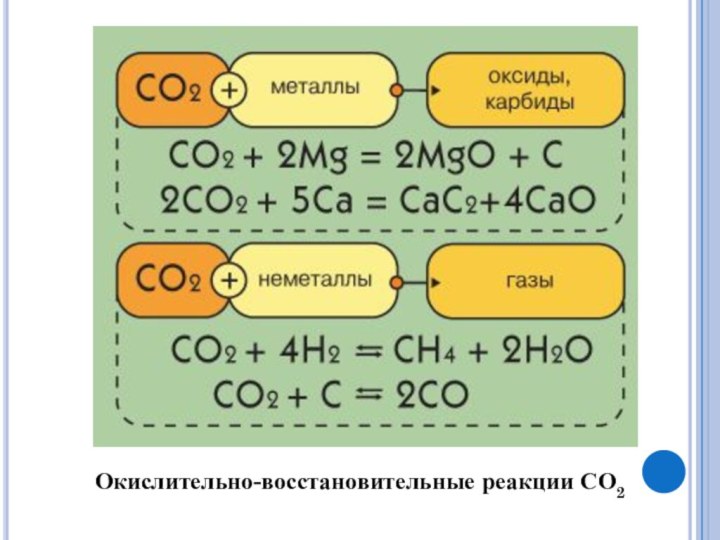




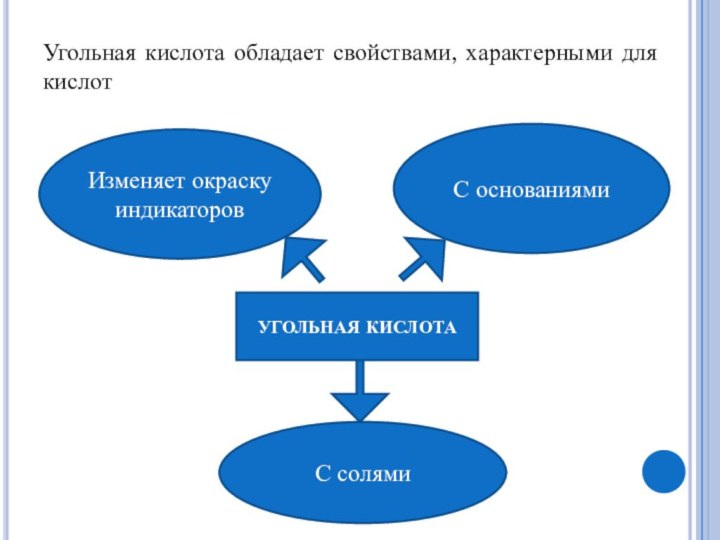




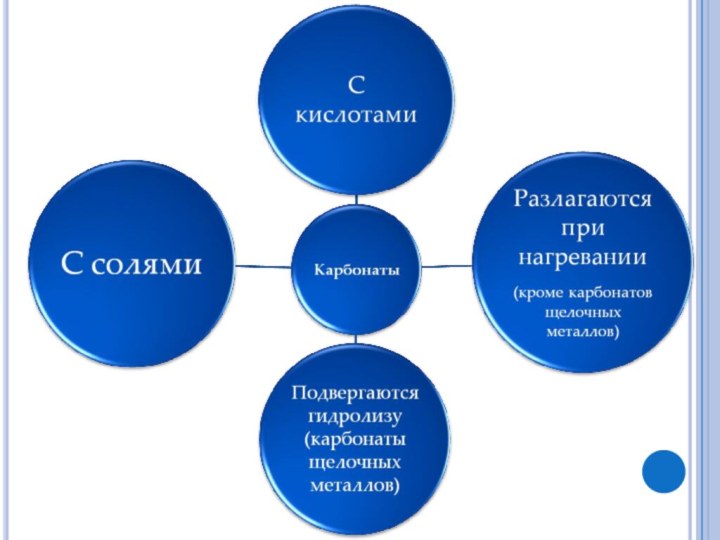

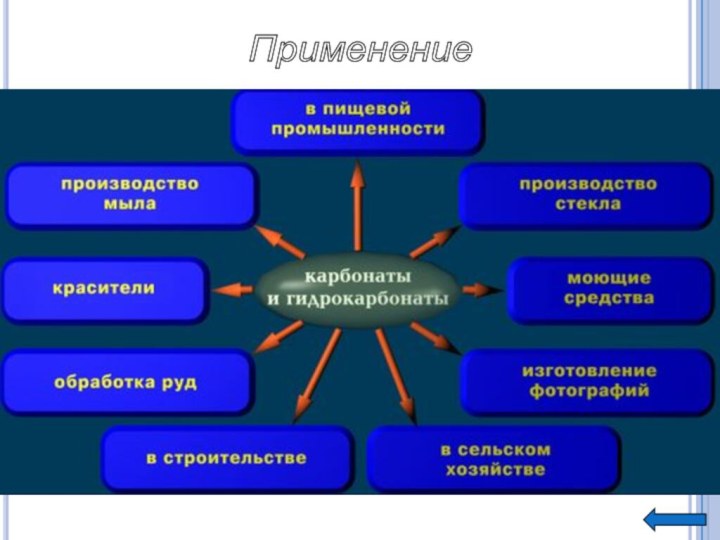

Получение СО2