- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Неорганические полимеры
Содержание
- 2. Неорганические полимерыНеорганические полимеры — полимеры, не содержащие
- 3. Классификация полимеров1. Гомоцепные полимеры Углерод и халькогены
- 4. Минеральное волокно асбест
- 5. Характеристика асбестаАсбест (греч. ἄσβεστος, — неразрушимый) —
- 6. Химический составПо химическому составу асбесты представляют собой
- 7. БезопасностьАсбест практически инертен и не растворяется в
- 8. Применение асбестаПроизводства огнеупорных тканей (в том числе
- 9. Роль неорганических полимеров в формировании литосферы
- 10. ЛитосфераЛитосфера — твёрдая оболочка Земли. Состоит из земной коры и верхней
- 12. Химический составОсновными компонентами земной коры и поверхностного
- 13. ГранитГранит - кислая магматическая интрузивная горная порода. Состоит из кварца, плагиоклаза, калиевого полевого
- 14. БазальтМинеральный состав. Основная масса сложена микролитами плагиоклазов,
- 15. Кварц (Оксид кремния(IV), кремнезем)
- 16. Формула: SiO2Цвет: бесцветный, белый, фиолетовый, серый, жёлтый,
- 19. α-кварцКристаллическая решетка кварца
- 20. Химические свойства
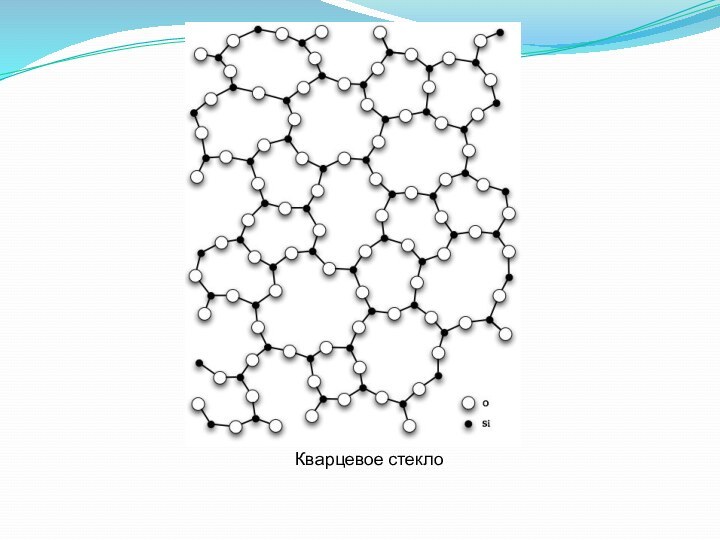
- 21. Кварцевое стекло
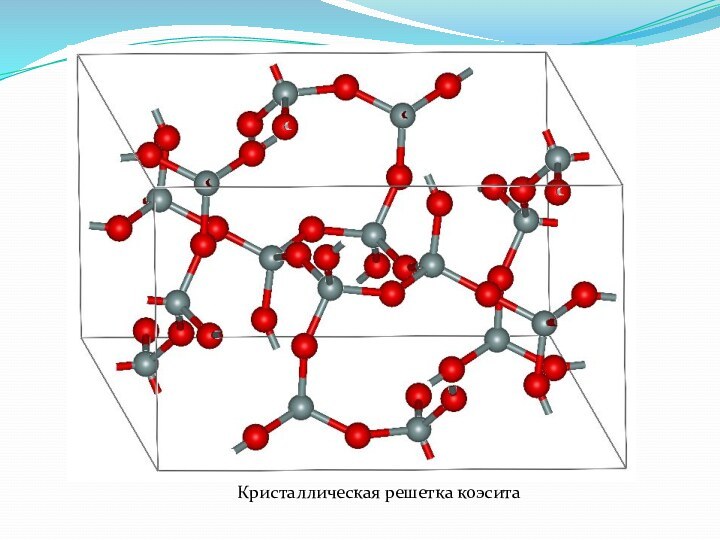
- 22. Кристаллическая решетка коэсита
- 23. ПрименениеКварц используется в оптических приборах, в генераторах
- 24. Корунд (Al2O3 , глинозем)
- 25. Формула: Al2O3Цвет: голубой, красный, жёлтый, коричневый, серыйЦвет черты: белаяБлеск: стеклянныйПлотность: 3,9—4,1 г/см³Твердость: 9
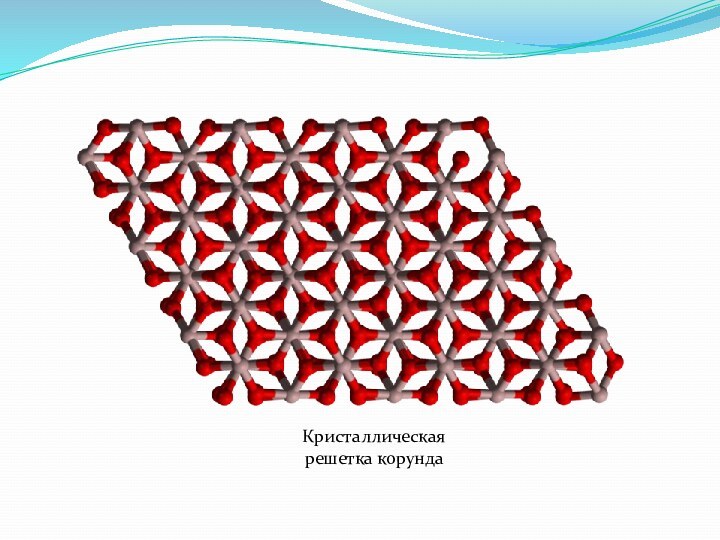
- 26. Кристаллическая решетка корунда
- 27. ПрименениеИспользуют как абразивный материалИспользуется как огнеупорный материалДрагоценные камни
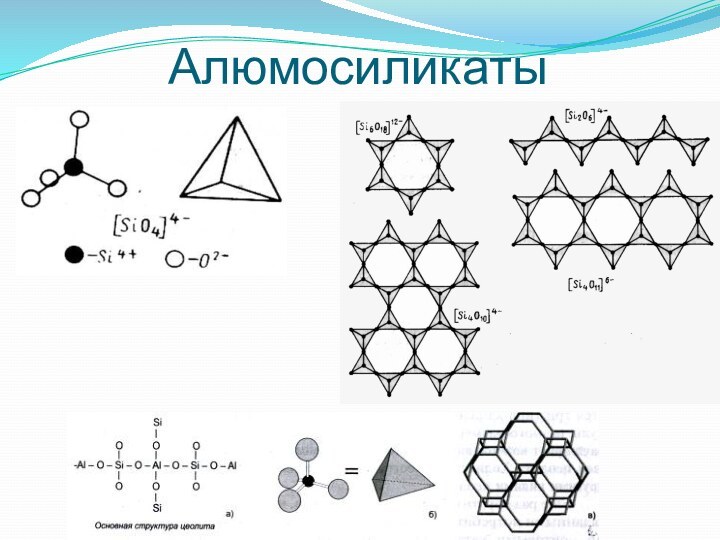
- 29. Алюмосиликаты
- 30. Алюмосиликаты
- 31. Теллур
- 32. Теллур цепочечного строенияКристаллы - гексагональные, атомы в
- 33. Применение теллура Производстве полупроводниковых материаловПроизводство резиныВысокотемпературная сверхпроводимость
- 34. Селен
- 35. Селен цепочечного строения
- 36. Серый селенСерый селен (иногда его называют металлическим)
- 37. Применение серого селенаОбычный серый селен обладает полупроводниковыми
- 38. Красный селенКрасный селен представляет собой менее устойчивую
- 39. Сера
- 40. Ромбическая и моноклинная модификации построены из циклических
- 41. Особенности строенияПластическая модификация серы образована спиральными цепями
- 42. Ромбическая сераМоноклинная сераПластическая сераРасплав серы при медленном охлажденииПри комнатной t°При добавлении холодной водыПри комнатной t°
- 43. Получение пластической серы
- 44. Применение серыПолучение серной кислоты; В бумажной промышленности;в
- 45. Аллотропные модификации углерода
- 46. Сравнительная характеристика
- 47. Применение аллотропных модификаций углеродаАлмаз – в промышленности:
- 48. Скачать презентацию
- 49. Похожие презентации
Неорганические полимерыНеорганические полимеры — полимеры, не содержащие в повторяющемся звене связей C-C, но способные содержать органический радикал как боковые заместители.










































Слайд 3
Классификация полимеров
1. Гомоцепные полимеры
Углерод и халькогены (пластическая
модификация серы).
2. Гетероцепные полимеры
Способны многие пары элементов, например кремний
и кислород (силикон), ртуть и сера (киноварь).
Слайд 5
Характеристика асбеста
Асбест (греч. ἄσβεστος, — неразрушимый) — собирательное
название группы тонковолокнистых минералов из класса силикатов. Состоят из
тончайших гибких волокон.Ca2Mg5Si8O22(OH)2 -формула
Два основных типа асбестов — серпентин-асбест (хризотил-асбест, или белый асбест) и амфибол-асбесты
Слайд 6
Химический состав
По химическому составу асбесты представляют собой водные
силикаты магния, железа, отчасти кальция и натрия. К классу
хризотил-асбестов относятся следующие вещества:Mg6[Si4O10](OH)8
2Na2O*6(Fe,Mg)O*2Fe2O3*17SiO2*3Н2О
Волокна асбеста
Слайд 7
Безопасность
Асбест практически инертен и не растворяется в жидких
средах организма, но обладает заметным канцерогенным эффектом. У людей,
занятых на добыче и переработке асбеста, вероятность возникновения опухолей в несколько раз больше, чем у основного населения. Чаще всего вызывает рак лёгких, опухоли брюшины, желудка и матки.На основе результатов всесторонних научных исследований канцерогенных веществ, Международное агентство по изучению рака отнесло асбест к первой, наиболее опасной категории списка канцерогенов.
Слайд 8
Применение асбеста
Производства огнеупорных тканей (в том числе для
пошива костюмов для пожарных).
В строительстве (в составе асбесто-цементных смесей
для производства труб и шифера).В местах, где требуется снизить влияние кислот.
Слайд 10
Литосфера
Литосфера — твёрдая оболочка Земли. Состоит из земной коры и верхней части мантии,
до астеносферы.
Литосфера под океанами и континентами значительно различается. Литосфера под
континентами состоит из осадочного, гранитного и базальтового слоев общей мощностью до 80 км. Литосфера под океанами претерпела множество этапов частичного плавления в результате образования океанической коры, она сильно обеднена легкоплавкими редкими элементами, в основном состоит из дунитов и гарцбургитов, её толщина составляет 5—10 км, а гранитный слой полностью отсутствует.
Слайд 12
Химический состав
Основными компонентами земной коры и поверхностного грунта
Луны являются оксиды Si и Al и их производные.
Такой вывод можно сделать исходя из существующих представлений о распространенности базальтовых пород. Первичным веществом земной коры является магма - текучая форма горной породы, содержащая наряду с расплавленными минералами значительное количество газов. При выходе на поверхность магма образует лаву, последняя застывая образует базальтовые породы. Основной химический компонент лавы - кремнезем, или диоксид кремния, SiO2 . Однако при высокой температуре атомы кремния могут легко замещаться на другие атомы, например алюминия, образуя различного рода алюмосиликаты. В целом литосфера представляет собой силикатную матрицу с включением других веществ, образовавшихся в результате физических и химических процессов, протекавших в прошлом в условиях высокой температуры и давления. Как сама силикатная матрица, так и включения в нее содержат по преимуществу вещества в полимерной форме, то есть гетероцепные неорганические полимеры.
Слайд 13
Гранит
Гранит - кислая магматическая интрузивная горная порода. Состоит из кварца, плагиоклаза, калиевого полевого шпата и
слюд — биотита и мусковита. Граниты очень широко распространены в континентальной земной коре.
Наибольшие объёмы гранитов
образуются в зонах коллизии, где сталкиваются две континентальные плиты и происходит утолщение континентальной коры. По мнению некоторых исследователей, в утолщённой коллизионной коре образуется целый слой гранитного расплава на уровне средней коры (глубина 10—20 км). Кроме того, гранитный магматизм характерен для активных континентальных окраин ,и в меньшей степени, для островных дуг.Минеральный состав гранита:
полевые шпаты — 60—65 %;
кварц — 25—30 %;
темноцветные минералы (биотит, редко роговая обманка) — 5—10 %.
Слайд 14
Базальт
Минеральный состав. Основная масса сложена микролитами плагиоклазов, клинопироксена,
магнетита или титаномагнетита, а также вулканическим стеклом. Наиболее распространенным
акцессорным минералом является апатит.Химический состав. Содержание кремнезёма (SiO2) колеблется от 45 до 52-53 %, сумма щелочных оксидов Na2O+K2O до 5 %,в щелочных базальтах до 7 %. Прочие оксиды могут распределяться так: TiO2=1.8-2.3 %; Al2O3=14.5-17.9 %; Fe2O3=2.8-5.1 %; FeO=7.3-8.1 %; MnO=0.1-0.2 %; MgO=7.1-9.3 %; CaO=9.1-10.1 %; P2O5=0.2-0.5 %;
Слайд 16
Формула: SiO2
Цвет: бесцветный, белый, фиолетовый, серый, жёлтый, коричневый
Цвет
черты: белая
Блеск: стеклянный, в сплошных массах иногда жирный
Плотность: 2,6—2,65
г/см³Твердость: 7
Слайд 23
Применение
Кварц используется в оптических приборах, в генераторах ультразвука,
в телефонной и радиоаппаратуре
В больших количествах потребляется стекольной и
керамической промышленностьюМногие разновидности используются в ювелирном деле.
Слайд 25
Формула: Al2O3
Цвет: голубой, красный, жёлтый, коричневый, серый
Цвет черты:
белая
Блеск: стеклянный
Плотность: 3,9—4,1 г/см³
Твердость: 9
Слайд 27
Применение
Используют как абразивный материал
Используется как огнеупорный материал
Драгоценные камни
Слайд 32
Теллур цепочечного строения
Кристаллы - гексагональные, атомы в них
образуют спиральные цепи и связаны ковалентными связями с ближайшими
соседями. Поэтому элементарный теллур можно считать неорганическим полимером. Кристаллическому теллуру свойствен металлический блеск, хотя по комплексу химических свойств его скорее можно отнести к неметаллам.
Слайд 33
Применение теллура
Производстве полупроводниковых материалов
Производство резины
Высокотемпературная сверхпроводимость
Слайд 36
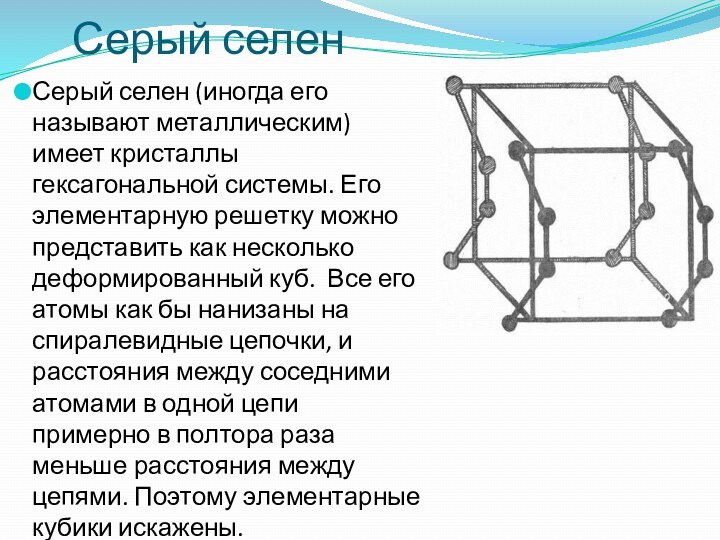
Серый селен
Серый селен (иногда его называют металлическим) имеет
кристаллы гексагональной системы. Его элементарную решетку можно представить как
несколько деформированный куб. Все его атомы как бы нанизаны на спиралевидные цепочки, и расстояния между соседними атомами в одной цепи примерно в полтора раза меньше расстояния между цепями. Поэтому элементарные кубики искажены.
Слайд 37
Применение серого селена
Обычный серый селен обладает полупроводниковыми свойствами,
это полупроводник p-типа, т.е. проводимость в нем создается главным
образом не электронами, а «дырками».Другое практически очень важное свойство селена-полупроводника – его способность резко увеличивать электропроводность под действием света. На этом свойстве основано действие селеновых фотоэлементов и многих других приборов.
Слайд 38
Красный селен
Красный селен представляет собой менее устойчивую аморфную
модификацию.
Полимер цепного строения, но малоупорядоченной структуры. В температурном интервале
70-90°С он приобретает каучукоподобные свойства, переходя в высокоэластичное состояние.Не имеет определенной температуры плавления.
Красный аморфный селен при повышении температуры ( - 55) начинает переходить в серый гексагональный селен
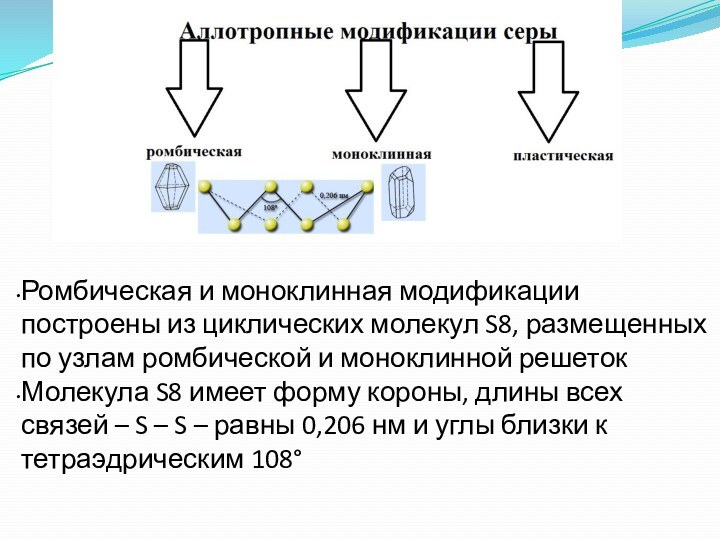
Слайд 40 Ромбическая и моноклинная модификации построены из циклических молекул
S8, размещенных по узлам ромбической и моноклинной решеток
Молекула S8 имеет
форму короны, длины всех связей – S – S – равны 0,206 нм и углы близки к тетраэдрическим 108°
Слайд 41
Особенности строения
Пластическая модификация серы образована спиральными цепями из
атомов серы с левой и правой осями вращения. Эти
цепочки скручены и вытянуты в одном направлении.Пластическая сера неустойчива и самопроизвольно превращаются в ромбическую.
Слайд 42
Ромбическая сера
Моноклинная сера
Пластическая сера
Расплав серы при медленном охлаждении
При
комнатной t°
При добавлении холодной воды
При комнатной t°
Слайд 44
Применение серы
Получение серной кислоты;
В бумажной промышленности;
в сельском
хозяйстве (для борьбы с болезнями растений, главным образом винограда
и хлопчатника);в производстве красителей и светящихся составов;
для получения черного (охотничьего) пороха;
в производстве спичек;
мази и присыпки для лечения некоторых кожных заболеваний.
Слайд 47
Применение аллотропных модификаций углерода
Алмаз – в промышленности: его
используют для изготовления ножей, свёрл, резцов; в ювелирном деле. Перспектива – развитие
микроэлектроники на алмазных подложках.Графит – для изготовления плавильных тиглей, электродов; наполнитель пластмасс; замедлитель нейтронов в ядерных реакторах; компонент состава для изготовления стержней для чёрных графитовых карандашей (в смеси с каолином)
Фуллерен – в аккумуляторах и электрических батареях (добавки фуллерена); фармакология (лечение ВИЧ); солнечные элементы; огнезащитные краски.
Карбин – фотоэлементы.