- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Растворение. Растворимость веществ в воде
Содержание
- 2. Вода – универсальный растворитель на Земле..
- 4. Изучение растворов занимает одно из центральных мест в химии.
- 5. Якоб Хендрик Вант-ГоффСванте Август АррениусВильгельм Фридрих Оствальд
- 6. Раствор – однородная смесь, состоящая из двух
- 7. Дмитрий Иванович Менделеев
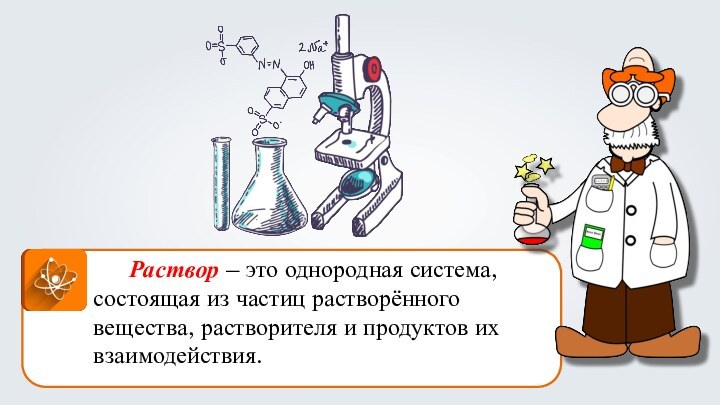
- 8. Раствор – это однородная система, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия.
- 9. Теория, объединяющая химическую и физическую теории растворов была высказана Д.И. Менделеевым в 1906 году.
- 10. растворённое веществоводагидраты
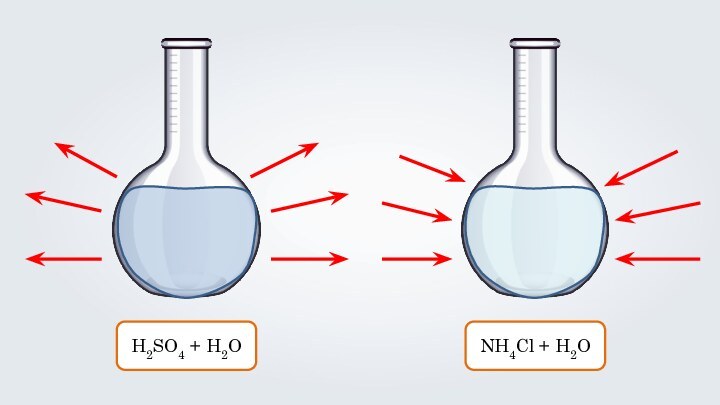
- 11. H2SO4 + H2ONH4Cl + H2O
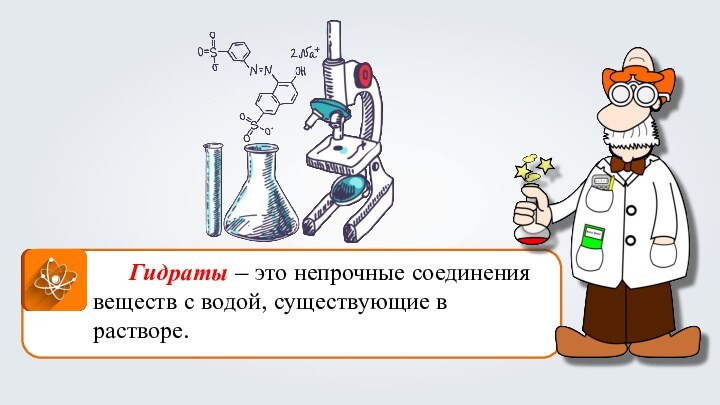
- 12. Гидраты – это непрочные соединения веществ с водой, существующие в растворе.
- 13. Кристаллогидратыглауберова соль (Na2SO4·10H2O)медный купорос (CuSO4·5H2O) железный купорос (FeSO4·7H2O)
- 14. m=100 гm=200 гРастворимость веществ в воде зависит от их природы (состава, строения) и температурных условий
- 15. m=100 гm=35,9 гРастворимость веществ в воде зависит от их природы (состава, строения) и температурных условий
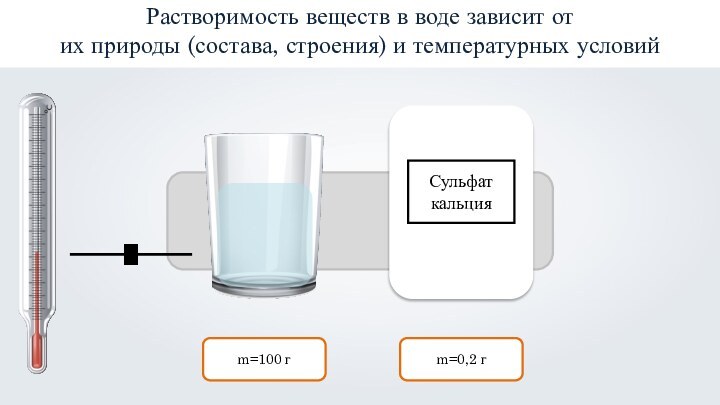
- 16. m=100 гm=0,2 гРастворимость веществ в воде зависит от их природы (состава, строения) и температурных условий
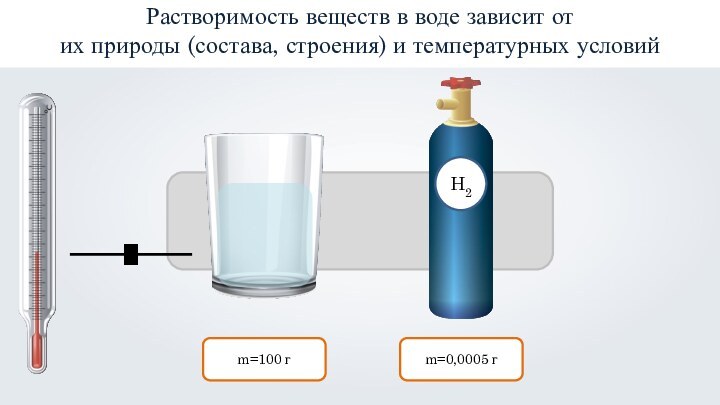
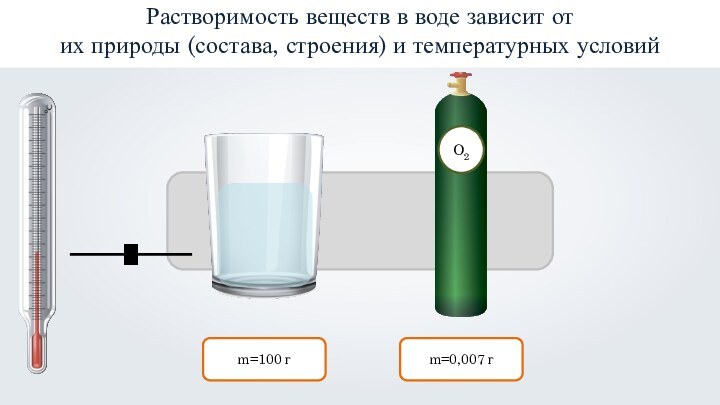
- 17. m=100 гm=0,0005 гРастворимость веществ в воде зависит от их природы (состава, строения) и температурных условий
- 18. m=100 гm=0,007 гРастворимость веществ в воде зависит от их природы (состава, строения) и температурных условий
- 19. При повышении температуры растворимость газов уменьшается. Растворимость твёрдых веществ с повышением температуры увеличивается.
- 20. В зависимости от количества растворённого в растворителе
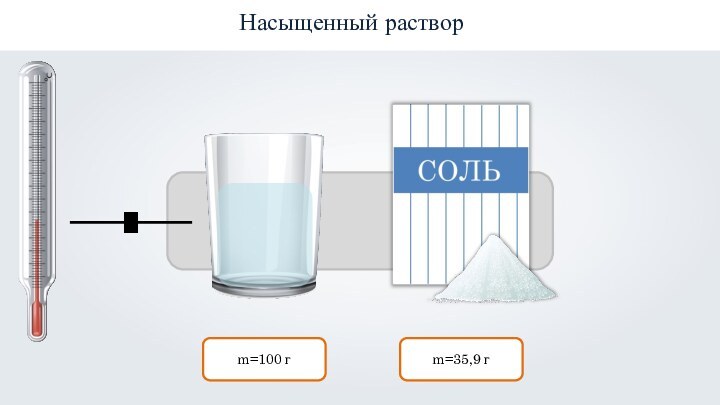
- 21. Насыщенным называют такой раствор, в котором при данной температуре вещество больше не растворяется.
- 22. m=100 гm=35,9 гНасыщенный раствор
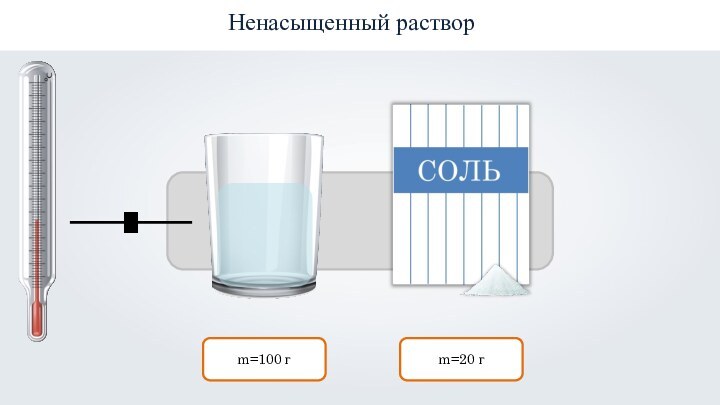
- 23. Ненасыщенным называют такой раствор, в котором при
- 24. m=100 гm=20 гНенасыщенный раствор
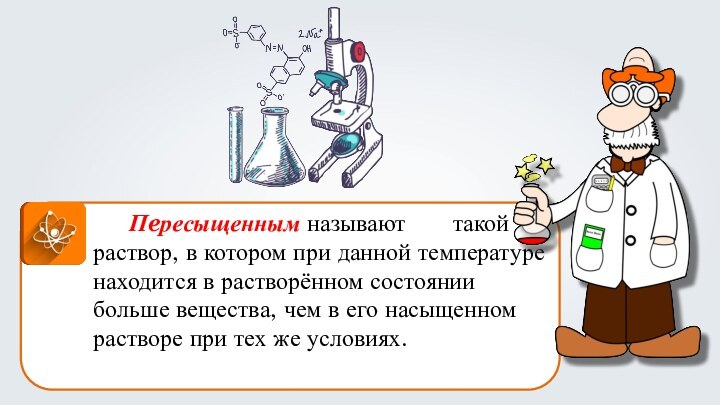
- 25. Пeресыщенным называют такой раствор,
- 26. Приготовление пересыщенного раствора
- 27. Приготовление пересыщенного раствора22
- 28. Приготовление пересыщенного раствора22
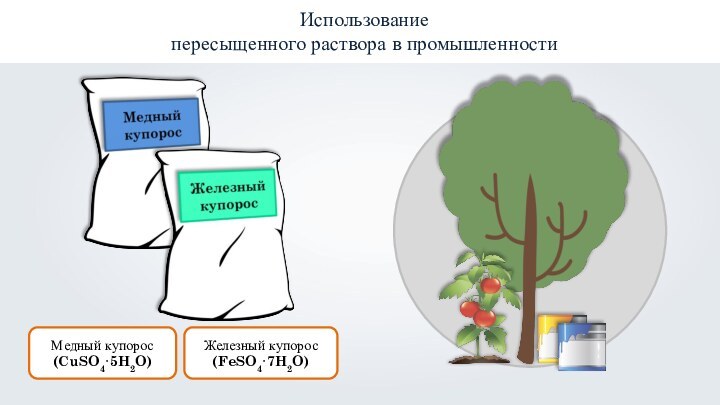
- 29. Использованиепересыщенного раствора в промышленностиЖелезный купорос(FeSO4·7H2O)Медный купорос (CuSO4·5H2O)
- 30. Использованиепересыщенного раствора в промышленностиГлауберова соль (Na2SO4·10H2O)
- 31. Природным примером пересыщенных растворов служат существующие на земле солёные озера.
- 32. В зависимости от способности вещества растворятся в
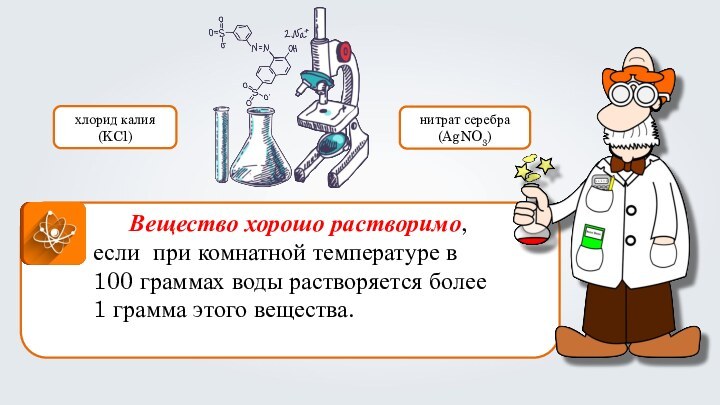
- 33. Вещество хорошо растворимо, если при комнатной температуре
- 34. Вещество малорастворимо, если при комнатной температуре в
- 35. Нерастворимыми называют вещества, растворимость которых меньше 0,01
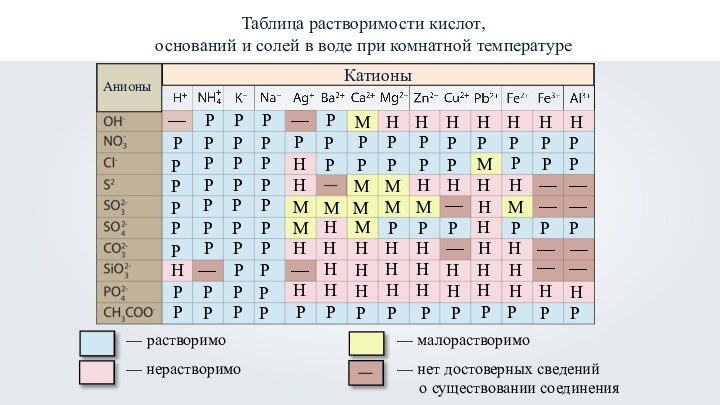
- 36. Таблица растворимости кислот, оснований и солей в
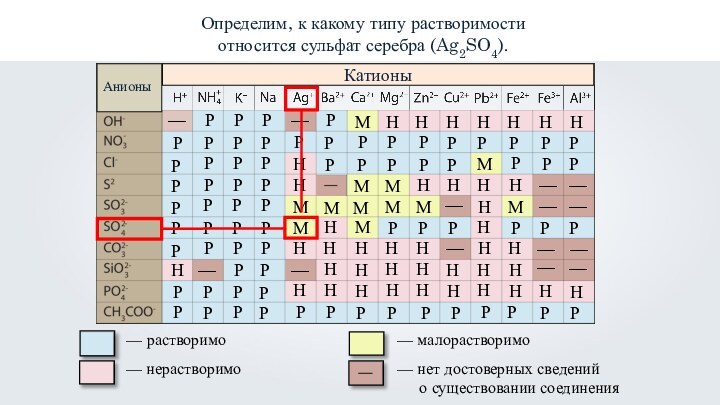
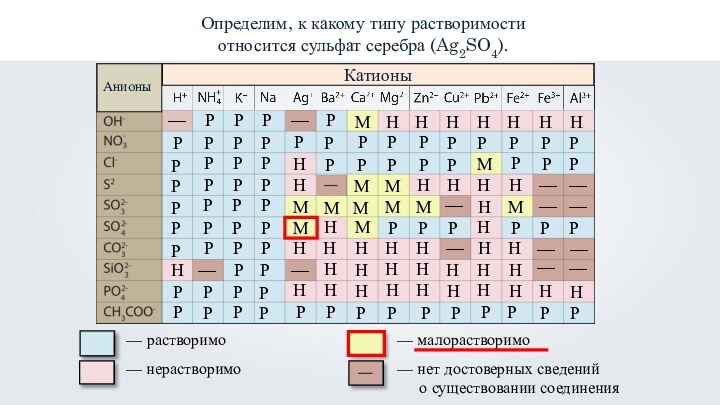
- 37. Определим, к какому типу растворимости относится сульфат
- 38. Определим, к какому типу растворимости относится сульфат серебра (Ag2SO4).
- 39. Скачать презентацию
- 40. Похожие презентации
Вода – универсальный растворитель на Земле..






















Слайд 6 Раствор – однородная смесь, состоящая из двух или
более однородных частей.
Процесс растворения является
процессом диффузии.
Слайд 8
Раствор – это однородная система, состоящая из частиц
растворённого вещества, растворителя и продуктов их взаимодействия.
Слайд 9
Теория, объединяющая химическую и физическую теории растворов была
высказана Д.И. Менделеевым в 1906 году.
Слайд 13
Кристаллогидраты
глауберова соль
(Na2SO4·10H2O)
медный купорос
(CuSO4·5H2O)
железный купорос
(FeSO4·7H2O)
Слайд 14
m=100 г
m=200 г
Растворимость веществ в воде зависит от
их природы (состава, строения) и температурных условий
Слайд 15
m=100 г
m=35,9 г
Растворимость веществ в воде зависит от
их природы (состава, строения) и температурных условий
Слайд 16
m=100 г
m=0,2 г
Растворимость веществ в воде зависит от
их природы (состава, строения) и температурных условий
Слайд 17
m=100 г
m=0,0005 г
Растворимость веществ в воде зависит от
их природы (состава, строения) и температурных условий
Слайд 18
m=100 г
m=0,007 г
Растворимость веществ в воде зависит от
их природы (состава, строения) и температурных условий
Слайд 19 При повышении температуры растворимость газов уменьшается. Растворимость твёрдых
веществ с повышением температуры увеличивается.
Слайд 20 В зависимости от количества растворённого в растворителе вещества
раствор может быть:
– насыщенным,
– ненасыщенным,– пересыщенным.
Слайд 21
Насыщенным называют такой раствор, в котором при данной
температуре вещество больше не растворяется.
Слайд 23
Ненасыщенным называют такой раствор, в котором при данной
температуре находится меньше растворяемого вещества, чем в его насыщенном
растворе.
Слайд 25
Пeресыщенным называют такой раствор, в
котором при данной температуре находится в растворённом состоянии больше
вещества, чем в его насыщенном растворе при тех же условиях.
Слайд 29
Использование
пересыщенного раствора в промышленности
Железный купорос
(FeSO4·7H2O)
Медный купорос (CuSO4·5H2O)
Слайд 32
В зависимости от способности вещества
растворятся в воде,
оно может быть:
– хорошо растворимым,
– малорастворимым,
– нерастворимым.
Слайд 33
Вещество хорошо растворимо, если при комнатной температуре в
100 граммах воды растворяется более 1 грамма этого вещества.
хлорид
калия(KCl)
нитрат серебра
(AgNO3)
Слайд 34
Вещество малорастворимо, если при комнатной температуре в 100
граммах воды растворяется менее 1 грамма этого вещества.
сульфат кальция
(CaSO4)
хлорид свинца (PbCl2)