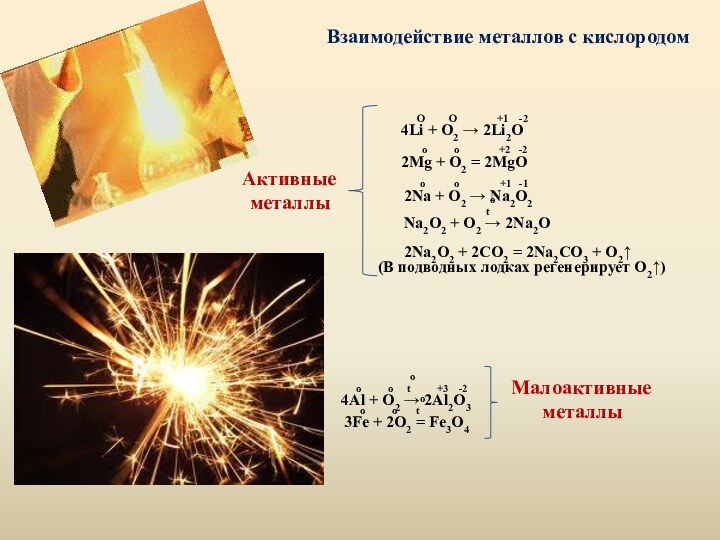
различают следующие методы защиты:
Защитные покрытия. Для изоляции металла от
окружающей среды на него наносят различного рода покрытия: лаки, краски, эмали.
Обработка внешней среды, в которой протекает коррозия. Для максимального замедления процесса коррозии в окружающую среду вводят ингибиторы.
Электрохимическая защита – протекторная и катодная. Протекторная – защищаемое от коррозии изделие соединяют с металлическим ломом из более электроотрицательного металла (протекторная). Катодная – защищаемая конструкция, находящаяся в электролите (почвенная вода), подсоединяется к катоду внешнего источника тока.
Покрытие слоем другого металла (Au, Ag, Cr, Ni, Zn. Sn- или Pb-лужение).
Использование нержавеющих сплавов (хрома, никеля, титана).
(Fe +H2SO4 – добавляют HNO3)
Памятник Ю.А.Гагарину в Москве, выполненный из титана