- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
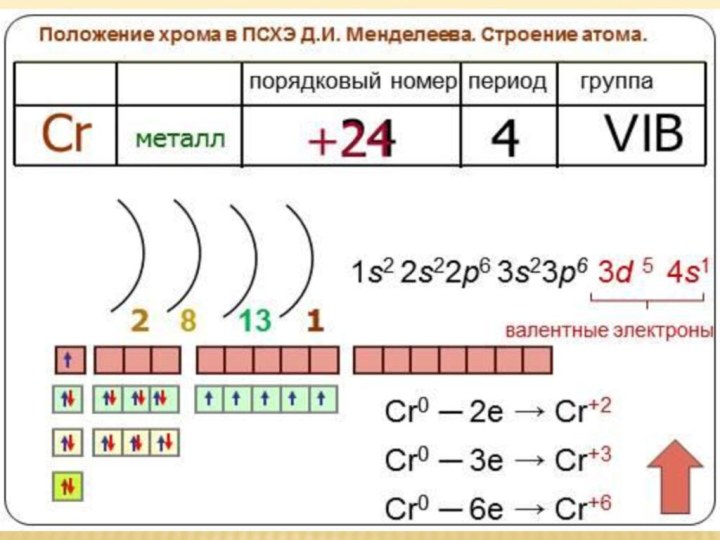
Презентация на тему по химии на тему Хром и его соединения 10 класс
Содержание
- 2. Хром (лат. Cromium) , металл голубовато-стального цвета.
- 5. История открытияВ 1797 г. французский химик Л.
- 6. Выделить этот элемент в чистом виде
- 7. Нахождение в природе: Хром встречается в виде
- 8. Месторождения хромаВ земной коре хрома довольно много
- 9. Физические свойства: Хром - серебристо-белый металл. Температура
- 10. Химические свойства: Хром химически малоактивен. В обычных условиях он
- 11. Металлический хром при нагревании реагирует с галогенами, галогено-водородами,
- 13. В азотной и концентрированной серной кислотах хром пассивируется, покрываясь оксидной
- 14. Оксиды и гидроксиды хрома: Хром образует следующие оксиды и гидроксиды:СrO Сг(ОН)2Сг2O3 Сг(ОН)3CrO3 Н2СrO4
- 15. Оксид хрома (II) СrО — пирофорный черный порошок (пирофорность
- 16. Соединения хрома (II) легко окисляются кислородом воздуха
- 17. Сг2О3 - тугоплавкий порошок зеленого цвета. По твёрдости близок к
- 18. При растворении оксида и гидроксида (III) в растворах щелочей образуются комплексные соединения
- 19. С кислотами Cr2O3 и Cr(OH)3 дают соли хрома (III):Cr2O3 + 6HCl =
- 20. Оксид хрома(Vi) темно- красное кристаллическое вещество-Оксид
- 21. СгО3 легко растворяется в воде, образуя хромовые кислоты.
- 22. Вывод:С возрастанием степени окисления основные свойства гидроксидов ослабевают, а кислотные усиливаются.Сr(ОН)2 - основной гидроксид Сr(ОН)3 - амфотерный гидроксид - кислотные свойства
- 23. Хроматы и дихроматыХроматы образуются при взаимодействии СгО3,
- 24. Для соединений хрома характерны окислительно - восстановительные реакции.Соединения хрома (II)
- 25. 2Na3 [Сг(OH)6] + ЗВг2 + 4NaOH = 2Na2CrO4 + 6NaBr +
- 26. Вывод:Таким образом, окислительные свойства последовательно усиливаются с изменением степеней окисления в ряду: Cr2+ → Cr3+ → Cr6+ .
- 27. Все растворы солей хрома имеют окраску:Cr2+ -----голубого
- 28. Применение: Хром является компонентом нержавеющих сталей. Стали,
- 29. Наглядное применение хрома
- 32. Роль хрома в живых организмахХром — один
- 33. Функции хрома в жизни человекаОсновная роль хрома
- 34. Скачать презентацию
- 35. Похожие презентации
Хром (лат. Cromium) , металл голубовато-стального цвета.
















![Презентация по химии на тему Хром и его соединения 10 класс При растворении оксида и гидроксида (III) в растворах щелочей образуются комплексные соединения хрома:Сг2О3 + 6NaOH + ЗН2О = 2Na3[(Cr(OH)6]](/img/tmb/6/573663/3b26fbe5fc21c1f93880a456e1f03d25-720x.jpg)






![Презентация по химии на тему Хром и его соединения 10 класс 2Na3 [Сг(OH)6] + ЗВг2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8Н2О5Cr2(SO4)3 + 6KMnO4 + 11H2O = 3K2Cr2O7 +](/img/tmb/6/573663/b5230cc22ff8ae52c2fcf30058af09fc-720x.jpg)









Слайд 5
История открытия
В 1797 г. французский химик Л. Вокелен
впервые исследовал красноватый, тяжелый минерал крокоизит, попавший в его
руки из далекой Сибири.Крокоизит, чаще называемый крокоитом (от греческого "крокос" - шафран), -редкий минерал, найденный на Урале в 40-х года XVIII в. и описанный М. В. Ломоносовым.
Затем он был найден в Сибири петербургским профессором химии И. Леманом в 1762 г.
От него попал к Вокелену, который открыл в сибирском минерале соединение нового элемента.
Слайд 6 Выделить этот элемент в чистом виде он
не смог. Пораженный разнообразием окрасок, образуемых разными соединениями вновь
открытого элемента, Вокелен назвал его хромом (от греческого слова "хрома" - цвет, краска).В сравнительно чистом виде новый элемент был выделен в 1799 г. Ф. Тассером.
Он представлял собой серо-стальной металл с серебристыми блестками в изломе, тугоплавкий (температура плавления 1800° С), не окисляющийся при обычных условиях, с плотностью, почти равной плотности железа.
Слайд 7
Нахождение в природе:
Хром встречается в виде соединений в
различных минералах - хромит, или хромистый железняк Fe(CrO2)2 и его paзнoвиднocти, в которых
железо частично замещено на Мд. Общее содержание хрома в земной коре 0,03%.
Слайд 8
Месторождения хрома
В земной коре хрома довольно много –
0,02%. Хромовая руда носит название хромитов или хромистого железняка
(потому, что почти всегда содержит и железо).Наша страна обладает огромными запасами хромитов. Одно из самых больших месторождений находится в Казахстане, в районе Актюбинска; оно открыто в 1936 г. Значительные запасы хромовых руд есть и на Урале.
Большими запасами хромитов располагают Куба, Югославия, многие страны Азии и Африки.
Слайд 9
Физические свойства:
Хром - серебристо-белый металл. Температура плавления 1890оС,
плотность 7,19 г/см3.
Чистый хром достаточно пластичен, а технический
- самый твёрдый из всех металлов.Природный хром состоит из смеси пяти изотопов с массовыми числами 50, 52, 53, 54 ,56.
Слайд 10
Химические свойства:
Хром химически малоактивен. В обычных условиях он реагирует только
с фтором (из неметаллов), образуя смесь фторидов.
При высокой температуре
хром горит в кислороде, образуя оксид Сг2Оз.to
4Сг + ЗО2 = 2Сг2О3
Слайд 11 Металлический хром при нагревании реагирует с галогенами, галогено-водородами, серой,
азотом, фосфором, углём, кремнием и бором.
Cr + 2HF =
CrF2 + Н22Cr + N2 = 2CrN
2Cr + 3S = Cr2S3
Cr + Si = CrSi
Слайд 13 В азотной и концентрированной серной кислотах хром пассивируется, покрываясь оксидной плёнкой.
Вхлороводородной и разбавленной серной кислотах растворяется, при этом если кислота полностью освобождена
от растворённого кислорода, получается (*)Раскалённый хром реагирует с парами воды:
2Сr + ЗН2О = Сг2О3 + ЗН2
соли хрома (II), а если реакция протекает на воздухе - соли хрома (III).
Сг + 2HCI = СгСl2 + Н2
4Cr + 12HCI + О2 = 4СrCl3 + 4Н2 + 2Н2О
Слайд 14
Оксиды и гидроксиды хрома:
Хром образует следующие оксиды и гидроксиды:
СrO Сг(ОН)2
Сг2O3 Сг(ОН)3
CrO3 Н2СrO4
Слайд 15 Оксид хрома (II) СrО — пирофорный черный порошок (пирофорность —
способность в тонкораздробленном состоянии воспламеняться на воздухе)
Оксид хрома (II) СгО и соответствующий
ему Сг(ОН)2, проявляют основные свойства:СrO + 2HCI = CrCl2 + Н2O
Оксид хрома (II) превращается в оксид хрома (III).
Сr(ОН)2 получают в виде жёлтого осадка при действии раствора щёлочи на СrCl2
Сг2+ + 2ОН- = Сг(ОН)2
Сг(ОН)2 - восстановитель
При прокаливании превращается в Сг2О3
Слайд 16 Соединения хрома (II) легко окисляются кислородом воздуха в
соединения хрома (III).
2Сг(ОН)2 + 1/2О2 + Н2О = 2Сг(ОН)3
оксид хрома (III)
Сг2О3 и гидроксид хрома (III) Сг(ОН)з - амфотерные соединения.
Слайд 17
Сг2О3 - тугоплавкий порошок зеленого цвета. По твёрдости близок к корунду.
Получается соединением элементов при высокой температуре.
В лаборатории получают нагреванием дихромата
аммония:t°
(NН4)2Сг2O7 = Сг2О3 + N2 + 4Н2O
Слайд 18
При растворении оксида и гидроксида (III) в растворах щелочей образуются комплексные соединения хрома:
Сг2О3 +
6NaOH + ЗН2О = 2Na3[(Cr(OH)6] при
сплавлении - метахромитыt°
Сг2О3 + 2КОН = 2КСrO2 + Н2О
и ортохромиты
t°
Cr(OH)3 + 3NaOH = Na3CrO3 + ЗН2О
Слайд 19
С кислотами Cr2O3 и Cr(OH)3 дают соли хрома (III):
Cr2O3 + 6HCl = 2CrCl3 +
3Н2О
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6Н2О
при прокаливании Cr(OH)3 образуется Сг2О3:
to2Cr(OH)3 = Cr2o3 + 3Н2О
Слайд 20
Оксид хрома(Vi) темно- красное кристаллическое вещество-
Оксид хрома
(VI) СгО3 - кислотный оксид. Получение:
К2Сг2О7 + H2SO4 = 2CrO3 + K2SO4 + Н2О
концСильный окислитель: окисляет йод, серу, фосфор, уголь, превращаясь в Сг2О3
3S + 4СгО3 = 3SO2 + 2Cr2O3
при нагревании до 250°С разлагается:
4СгО3 = 2Сг2О3 + ЗО2
Слайд 21 СгО3 легко растворяется в воде, образуя хромовые кислоты. С
избытком воды образует хромовую кислоту Н2CrO4 (соли - хроматы).
СгОз + Н2О
= Н2СгО4При большой концентрации СгО3 образуется дихромовая кислотаН2Сг2О? (соли - дихроматы).
2СгО3 + Н2О = Н2Сr2О7
Дихромовая кислота при разбавлении переходит в хромовую кислоту:
Н2Сr2О7 + Н2О = 2Н2СrО4
Хромовые кислоты существуют только в водном растворе.
Слайд 22
Вывод:
С возрастанием степени окисления основные свойства гидроксидов ослабевают, а кислотные
усиливаются.
Сr(ОН)2 - основной гидроксид Сr(ОН)3 - амфотерный гидроксид - кислотные свойства
Слайд 23
Хроматы и дихроматы
Хроматы образуются при взаимодействии СгО3, или
растворов хромовых кислот со щелочами:
СгОз + 2NaOH = Na2CrO4 + Н2О
Дихроматы получаются при
действии на хроматы кислот:2Na2Cr2O4 +H2SO4 = Na2Cr2O7 + Na2SO4 + Н2О
Слайд 24
Для соединений хрома характерны окислительно - восстановительные реакции.
Соединения хрома (II) -
сильные восстановители, они легкоокисляются
4CrСl2 + О2 + 4HCI = 4СгСlз + 2Н2О
Для соединений
хрома (!!!) характерны восстановительные свойства. Под действием окислителей они переходят:в хроматы - в щелочной среде,
в дихроматы - в кислой среде.
Слайд 25
2Na3 [Сг(OH)6] + ЗВг2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8Н2О
5Cr2(SO4)3 +
6KMnO4 + 11H2O = 3K2Cr2O7 + 2H2Cr2O7 + 6MnSO4 + 9H2SO4
Соли хромовых кислот
в кислой среде - сильные окислители:3Na2SO3 + К2Сг2О7 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O
Слайд 26
Вывод:
Таким образом, окислительные свойства последовательно усиливаются с изменением
степеней окисления в ряду: Cr2+ → Cr3+ → Cr6+ .
Слайд 27
Все растворы солей хрома имеют окраску:
Cr2+ -----голубого цвета
Cr3+ ---зелено– фиолетового цвета
CrO42- ---желтого цвета
Cr2О72- Оранжевого цвета
Слайд 28
Применение:
Хром является компонентом нержавеющих сталей. Стали, содержащие хром,
являются жаропрочными и обладают высокой стойкостью к коррозии.
К2Сг2О7 (хромпик), Na2Cr2O7 и (NH4)2Cr2O7 применяют
для дубления кожи, в производстве спичек, красок, взрывчатых веществ.
Слайд 32
Роль хрома в живых организмах
Хром — один из
биогенных элементов, постоянно входит в состав тканей растений и
животных.У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов.
Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В конце 1950-х гг. два исследователя, Шварц и Мерц, сообщили, что у крыс, которые были на рационе, дефицитном по хрому, развивалась непереносимость сахара; при добавлении же хрома в рацион их состояние нормализовалось.
Это было первым подтверждением, что хром необходим животным для нормальной жизни.
С тех пор исследователи поняли, что хром играет такую же роль и для здоровья человека.
Важные факты:
Слайд 33
Функции хрома в жизни человека
Основная роль хрома в
организме - это регуляция сахара в крови.
Хром работает вместе
с инсулином по перемещению сахара из крови в ткани
организма для использования или сох-
ранения. Этот микроэлемент настолько
важен для переносимости сахара, что
сильная его недостаточность приводит
к развитию диабетоподобного заболевания.
Уровень хрома снижается при дет-
ском диабете, при коронарном арте-
риальном заболевании (склерозиро-
вании артерий, ведущим к сердцу).
Хром необходим для нормального
метаболизма жиров («сжигания жиров»)
в организме и его недостаток однозначно
ведет к излишнему весу, ожирению.