- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии 8 класс на тему: Кислоты.
Содержание
- 2. Кислоты это сложные вещества, состоящие их
- 3. Кислоты - вещества, водные растворы которых образуют
- 4. Номенклатура кислот HCl - хлороводородная (соляная) -
- 5. Названия кислот:HCl – хлороводородная HBr - бромоводороднаяH+1N+5O3-2 – азотнаяH+1N+3O2-2 - азотистаяH2+1S+6O4-2 – сернаяH2+1S+4O3-2 - сернистаяN2O5, N2O3?
- 7. Кислотные свойства кислот, образованных элементами одного периода:H3BO3 - H2CO3 - H2SO4усиливаются Почему?
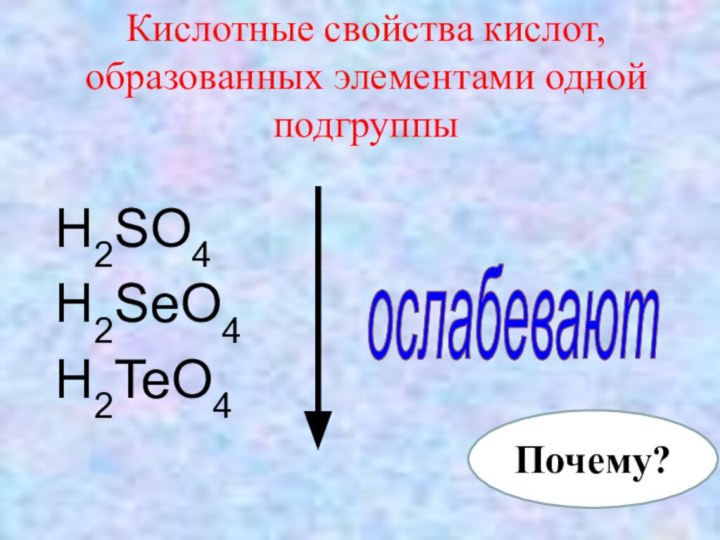
- 8. Кислотные свойства кислот, образованных элементами одной подгруппы H2SO4H2SeO4 H2TeO4ослабевают Почему?
- 9. Кислотные свойства кислот, образованных элементом в
- 10. Ряд активности кислотКислоты летучие (HCl, H2S, HNO3,
- 11. ОБЩИЕ СВОЙСТВА КИСЛОТКислый вкус;Действие на индикаторы;Электрическая проводимость;Химическое
- 12. Взаимодействие с индикаторамиПомни! Нерастворимые кислоты не меняют окраску индикаторов. ПОЧЕМУ?
- 13. Кислота (любая) + основание (р-р) = соль
- 14. Серная кислотаH2SO4H2SO4+1 +6 -2H2SO4+1 +6 -2разбавленнаяконцентр.H+ ―
- 15. HNO3 + Ме = Ме(NO3)x + ?
- 16. Скачать презентацию
- 17. Похожие презентации
Кислоты это сложные вещества, состоящие их атомов водорода, способных замещаться атомами металлов и кислотного остатка.Н Cl









Слайд 2
Кислоты
это сложные вещества, состоящие их
атомов водорода, способных замещаться атомами металлов и кислотного остатка.
ClСлайд 3 Кислоты - вещества, водные растворы которых образуют катионы водорода
и анионы кислотных остатков. HCl H++Cl- H3PO4
3H++PO43-
Слайд 4
Номенклатура кислот
HCl - хлороводородная (соляная) - хлорид
HF
- фтороводородная (плавиковая) - фторид
HBr – бромоводородная - бромид
HI
- йодоводородная - иодидH2S – сероводородная - сульфид
H2CO3 – угольная - карбонат
H2SO4 - серная - сульфат; H2SO3 – сернистая - сульфит
HNO3 - азотная - нитрат; HNO2 – азотистая - нитрит
H3PO4 – ортофосфорная - ортофосфат
HClO – хлорная - хлорат
HCN – синильная - цианид
Слайд 5
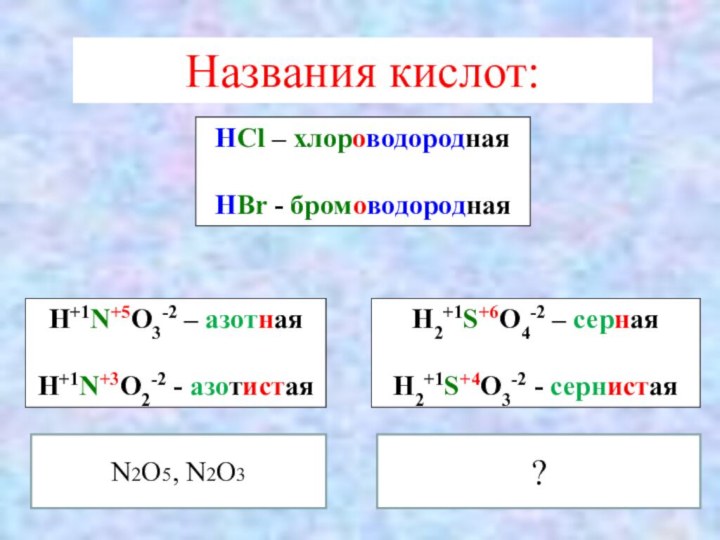
Названия кислот:
HCl – хлороводородная
HBr - бромоводородная
H+1N+5O3-2 –
азотная
H+1N+3O2-2 - азотистая
H2+1S+6O4-2 – серная
H2+1S+4O3-2 - сернистая
N2O5, N2O3
?
Слайд 7
Кислотные свойства кислот, образованных элементами одного периода:
H3BO3
- H2CO3 - H2SO4
усиливаются
Почему?
Слайд 8
Кислотные свойства кислот, образованных элементами одной подгруппы
H2SO4
H2SeO4
H2TeO4
ослабевают
Почему?
Слайд 9
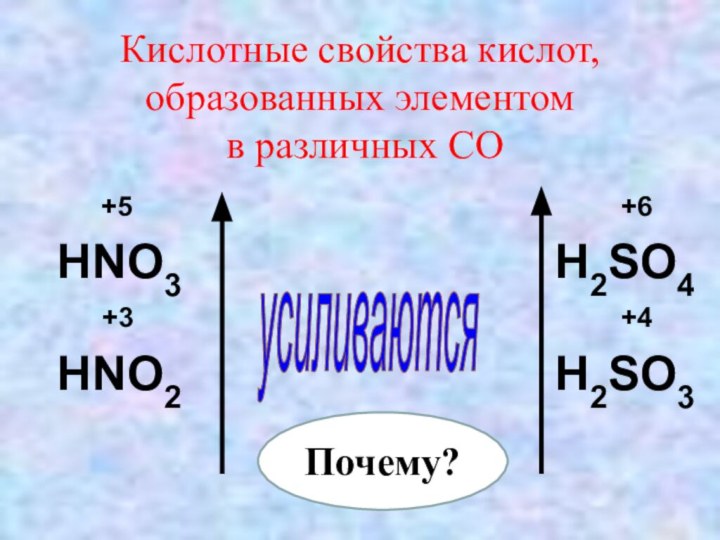
Кислотные свойства кислот, образованных элементом
в различных СО
+5
+6HNO3 H2SO4
+3 +4
HNO2 H2SO3
усиливаются
Почему?
Слайд 10
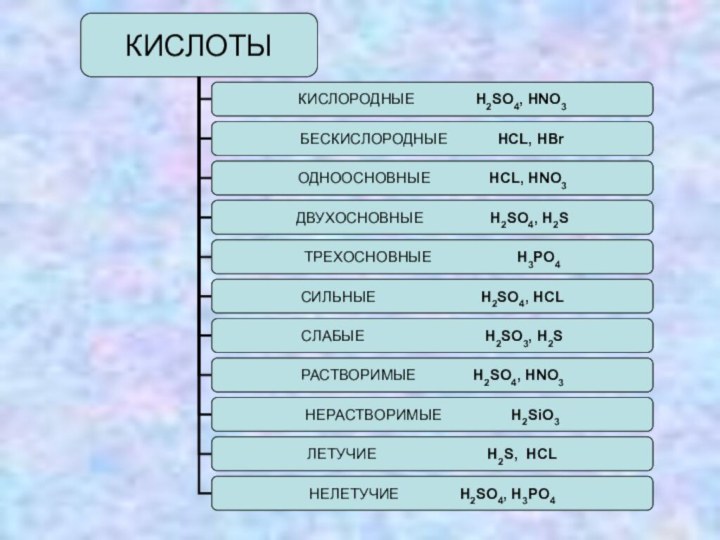
Ряд активности кислот
Кислоты летучие (HCl, H2S, HNO3, HClO4)
и нелетучие (большинство кислот – H2SO4, H3PO4, H2SiO3, HI
и др.).По устойчивости различают кислоты устойчивые (бескислородные и др.) и неустойчивые - H2CO3, H2SO3, H2SiO3, HNO3).
Слайд 11
ОБЩИЕ СВОЙСТВА КИСЛОТ
Кислый вкус;
Действие на индикаторы;
Электрическая проводимость;
Химическое взаимодействие
с металлами, основными и амфотерными оксидами, основаниями, солями;
Диссоциация
при растворении в воде.
Слайд 12
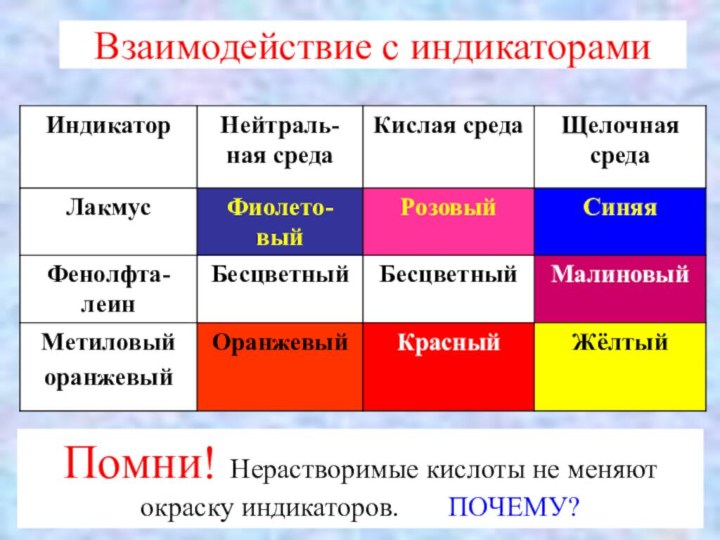
Взаимодействие с индикаторами
Помни! Нерастворимые кислоты не меняют окраску
индикаторов. ПОЧЕМУ?
Слайд 13 Кислота (любая) + основание (р-р) = соль +
вода
H2SO4 + NaOH =
А нерастворимое
основание растворяет только сильная кислота.Кислота + оксид металла = соль + вода
CuO + HCl =
Кислота (р-р) + металл = водород + соль
HCl +Zn =
Условия этой реакции:
- в ряду напряжений металл стоит до водорода;
в результате реакции должна получиться растворимая соль;
- кроме конц. и разб. HNO3 и конц. H2SO4
Кислота + соль = новая кислота + новая соль
BaCl2 + H2SO4 =
Условия: должны получиться газ, осадок или вода.
Нерастворимая кислота разлагается при нагревании: H2SiO3 =
Слайд 14
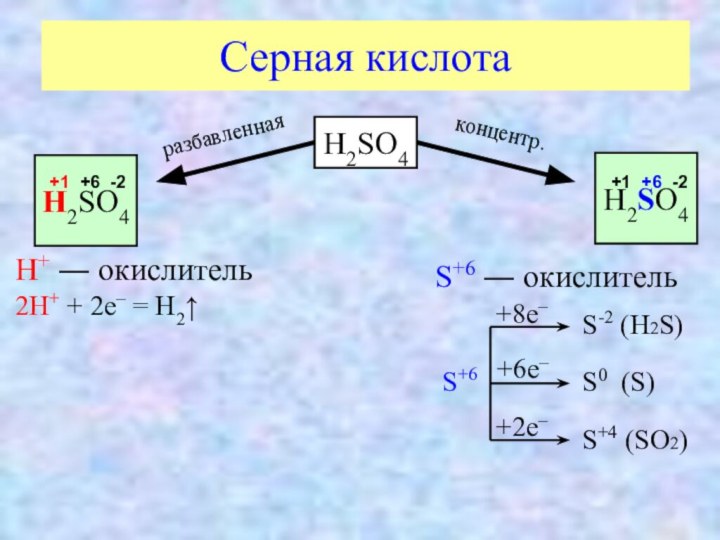
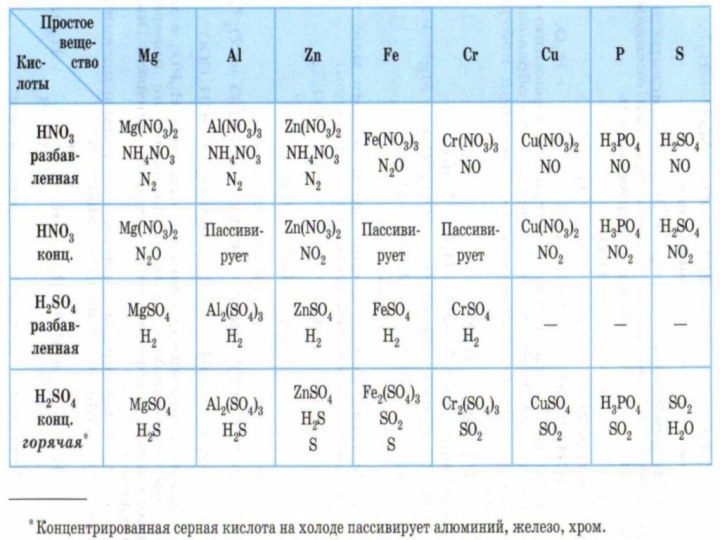
Серная кислота
H2SO4
H2SO4
+1 +6 -2
H2SO4
+1 +6 -2
разбавленная
концентр.
H+ ― окислитель
2H+
+ 2e– = H2↑
S+6 ― окислитель
S+6
+8e–
+6e–
+2e–
S-2 (H2S)
S0
(S)S+4 (SO2)
Слайд 15 HNO3 + Ме = Ме(NO3)x + ? +
H2O
H2SO4(конц.) + Ме(н/а) = МеSO4 + SO2 +
H2OС более активными Ме серная кислота
при определённых
условиях может восстанавливаться
до серы или сероводорода:
H2SO4(конц.) + Ме = МеSO4 + H2S (S) + H2O
На холоде конц. серная кислота пассивирует
железо и алюминий: H2SO4(конц.) + Fe ≠