Слайд 2
ТЕМА: Углерод.
Цель урока: изучить строение, свойства и применение
углерода и его аллотропных модификаций.
Задачи урока:
1.Образовательные
-закрепить знания о строении
вещества и зависимости свойств веществ от их строения
-рассмотреть химические свойство углерода с точки зрения окисления-восстановления
-дать сравнительную характеристику аллотропным модификациям углерода
-дать представление об адсорбции
- рассмотреть круговорот углерода в природе
2. Развивающие
-развивать умение сравнивать, обобщать, делать выводы
-использую дополнительный материал, способствовать развитию познавательной активности обучающихся
3.Воспитательные
-воспитывать культуру общения, наблюдательность
-воспитывать чувства взаимоуважения, взаимопомощи и аккуратности при выполнении химического эксперимента
-воспитание гордости за свою страну, ученых, совершивших много открытий в области химии.
Слайд 3
Оборудование: модели кристаллических решеток графита и алмаза, образцы
изделий из графита и сажи, древесный уголь, противогаз
На демонстрационном
столе: пробирки с раствором перманганата калия, таблетки карболена, химический стаканы, воронка ,фильтр
На столах обучающихся: прибор для восстановления меди из оксида меди , штатив, порошок древесного угля, оксид меди, спиртовка.
Тип урока: изучение нового материала.
Вид урока: исследовательско-поисковый.
Слайд 4
Ход урока.
I. Огрмомент. Целеполагание.
У доски два ученика
(диалог)
-Что это у тебя в руках?
-Да это я ребус
составила для урока
-Ну-ка, ну-ка, дай попробую угадать: (разочарованно) да это просто углерод, а я-то думала что-то интересное
-А ты считаешь, что углерод не интересен?
- Да что в нем интересного, уголь он и есть уголь, черный, пачкается
Учитель: давайте сейчас прервем спор этих учеников и попробуем в ходе нашего урока выяснить, кто же из ребят прав. Действительно ли углерод так прост или это не так? Какую цель для этого мы поставим перед собой сегодня на уроке? (ознакомиться со свойствами углерода.)
Слайд 5
II. Но, прежде чем говорить о свойствах веществ,

нужно обязательно вернуться к их строению (свойства определяются строением).
Вспомним строение атома углерода, обратимся к периодической системе.
III. Положение в периодической таблице Д.И.Менделеева. Строение атома.
У доски 1 обучающийся характеризует положение углерода в таблице и рассматривает строение атома.
Второй период, 4 группа, главная подгруппа. Состав атома- 6 протонов, 6 электронов , 6 нейтронов. Запись электронной и электронно-графической формул. Углерод неметалл. Относится к р-семейству.
Учитель: Какие степени окисления может проявлять углерод, ответ поясните
Обучающиеся: +4, -4, т.к. на внешнем уровне у него 4 электрона, которые он может отдавать - процесс окисления, и не хватает до завершения уровня тоже 4 электрона, которые он может принимать- процесс восстановления.
Учитель: Какие свойства будет проявлять углерод в окислительно-восстановительных реакциях? Обучающиеся: углерод может быть и окислителем и восстановителем.
Учитель: Какова степень окисления простого вещества углерода?
Обучающиеся: степень окисления простого вещества- 0.
Слайд 6
IV. Учитель: рассмотрим простые вещества, которые образует углерод.
Вспомните, что такое аллотроия , приведите примеры.
Обучающиеся: Аллотропия -
это способность атомов одного химического элемента образовывать несколько простых веществ. Например: фосфор красный и белый, кислород и озон.
Учитель: Углерод образует аллотропные модификации - графит, алмаз, карбин, фуллерен. Причина этого явления в разном строении кристаллических решеток ( демонстрация моделей решеток). Графит - плоскостная атомная, алмаз - объемная тетраэдрическая атомная, карбин - линейная, фуллерен сферическая. Существует «аморфный углерод».
Слайд 7
V. Обучающиеся выступают с сообщениями и презентациями о
аллотропных модификациях углерода (чередуются с фронтальной беседой).
Учитель: - Что
вы знаете об алмазах? Где они применяются? (очень твердые, из них делают ювелирные изделия)
1 ученик:
Алмаз. Прозрачное, бесцветное вещество с сильной лучепреломляемостью. Кристаллы алмаза отличаются особой прочной структурой, благодаря чему он обладает твердостью превосходящей твердость всех известных в природе веществ. Он в 1000 раз тверже кварца, в 150 раз- корунда. Окраска алмазов обусловлена примесями.
Слайд 8
Вес алмазов измеряется в каратах. 1 карат равен
0,2 г. Искусственно ограненные алмазы называются бриллиантами. Собрание исторических
бриллиантов и изделий из них хранится в Алмазном фонде Оружейной палаты Московского кремля и золотых кладовых Эрмитажа . Восьмилучевая звезда ордена Св. Андрея Первозванного сплошь усыпана бриллиантами различной величины.
Слайд 10
Исторический алмаз- «Шах» с незначительным желтоватым цветом. Был
найден в Центральной Индии в конце 16 века и
хранился у владетелей Ахмеднагары. В результате войн попал к монголам.. В 1739 г был увезен в Персию, а в 1829 г поднесен персидским шахом Николаю как выкуп за убийство русского дипломата и писателя А.С.Грибоедова.
Слайд 11
К коронации императрицы Екатерины была сделана Большая императорская
корона, состоящая из золота, серебра, бриллиантов, шпинели и жемчуга.
Общее число бриллиантов на короне-4936 штук, весом 2858 карат.
Слайд 12
Императорский скипетр сделан из золота, серебра, эмали, бриллиантов,
алмаза «Орлов». Алмаз был подарен императрице Екатерине графом Орловым
в 1774 г.
Слайд 13
Учитель: - Какие свойства графита и области применения
вы можете назвать, исходя из собственного опыта, и знаний,
полученных на других предметах? (серого цвета, жирный на ощупь, используется для изготовления стержней карандашей, электродов)
2 ученик:
Слайд 14
Графит
Графит - жирное на ощупь вещество черного или
серо-черного цвета с металлическим блеском
Слайд 15
Графит (от греч. grapho-пишу), аллотропная модификация углерода, наиболее
устойчивая при обычных условиях. Графит –распространенный в природе минерал.
Встречается обычно в виде отдельных чешуек, пластинок и скоплений, разных по величине и содержанию графита. Различают месторождения кристаллического графита, связанного с магматическими горными породами или кристаллическими сланцами, и скрытокристаллический графит, образовавшегося при метаморфизме углей. В кристаллических сланцах содержание графита составляет 3-20%, в магматических горных породах 3-50%, в углях 60-85%.
Слайд 16
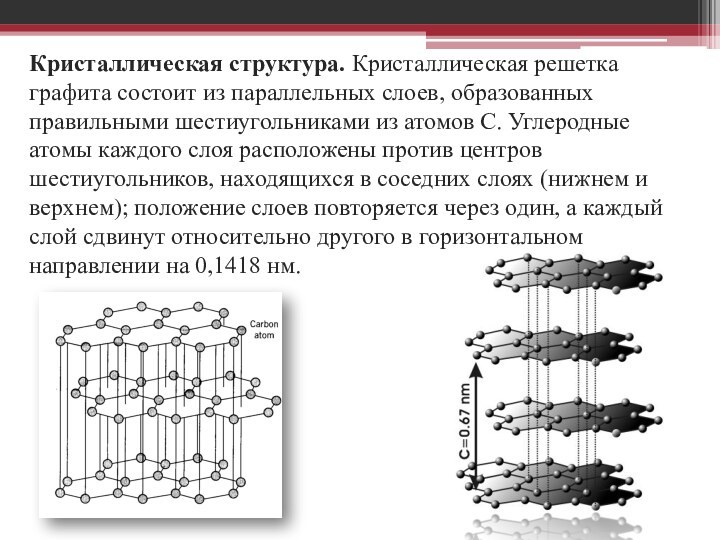
Кристаллическая структура. Кристаллическая решетка графита состоит из параллельных
слоев, образованных правильными шестиугольниками из атомов С. Углеродные атомы
каждого слоя расположены против центров шестиугольников, находящихся в соседних слоях (нижнем и верхнем); положение слоев повторяется через один, а каждый слой сдвинут относительно другого в горизонтальном направлении на 0,1418 нм.
Слайд 17
Применение. Графит используют в металлургии для изготовления плавильных

тиглей и лодочек, труб, испарителей, кристаллизаторов, футеровочных плит, чехлов
для термопар, в качестве противопригарной "присыпки" и смазки литейных форм. Он также служит для изготовления электродов и нагревательных элементов электрических печей, скользящих контактов для электрических машин, анодов и сеток в ртутных выпрямителях, самосмазывающихся подшипников и колец электромашин, вкладышей для подшипников скольжения, втулок для поршневых штоков, уплотнительных колец для насосов и компрессоров, как смазка для нагретых частей машин и установок. Его используют в атомной технике в виде блоков, втулок, колец в реакторах, как замедлитель тепловых нейтронов и конструкционных материалов, в ракетной технике - для изготовления сопел ракетных двигателей, деталей внешней и внутренней теплозащиты и др., в химическом машиностроении - для изготовления теплообменников, трубопроводов, запорной арматуры, деталей центробежных насосов и др., для работы с активными средами. Графит используют также как наполнитель пластмасс, компонент составов для изготовления стержней для карандашей, при получении алмазов. Пирографит наносится в виде покрытия на частицы ядерного топлива.
Слайд 18
3 ученик:
3) Карбин. Представляет собой мелкокристаллический порошок

черного цвета, обладает полупроводниковыми свойствами. Получен в искусственных условиях.
Это линейный полимер, с чередующимися одинарными и тройными связями. Это вещество впервые получено советскими химиками В.В.Коршаком, В.И.Касаточкиным, А.М.Сладковым, Ю.П.Кудрявцевым в начале 60 г. Карбин обладает полупроводниковыми свойствами и находит применение в фотоэлементах.
4) Фуллерены. Получены в 1985г., имеют сферическую форму (как футбольный мяч). Фуллерены представляют собой кристаллическое вещество черного цвета с металлическим блеском, обладающие свойствами полупроводников. Усилия многих ученых направлены на развитие нанотехнологии. В 1991 г японские ученые на стенках прибора, в котором проводили синтез фуллеренов, обнаружили наночастицы углерода- полые трубки. Нанотрубки являются на редкость прочным материалом, как на растяжение , так и на изгиб. Российскими и Французскими исследователями было открыто такое свойство нанотрубок , как сверхпроводимость.
5) Поликумулен. Еще одна аллотропная форма углерода. Это линейный полимер, в котором атомы углерода связаны только двойными связями. Получен искусственным путем.
Слайд 19
4 ученик:
6) Технический углерод. Высокодисперсный аморфный углерод.
Как было установлено исследователями, он не является аллотропным видоизменением
углерода, а представляет собой мелкокристаллический графит. Сортами этого углерода являются: древесный уголь, сажа, кокс. Древесный уголь получают при нагревании древесины без доступа воздуха. Он применяется в качестве топлива.
Слайд 20
VI. Адсорбция.
Учитель: однако больше известно применение древесного угля,
основанное на его способности к адсорбции- способности поглощать (
адсорбировать ) различные вещества . Открытое русским химиком Ловицем явление адсорбции используется для очистки сахара и спирта.
Слайд 21
Н.Д.Зелинский на основе адсорбционных свойств древесного угля разработал
фильтрующий противогаз.
Николай Дмитриевич Зелинский
(1861-1953) - профессор Московского Университета, академик, Герой Социалистического Труда
Слайд 22
Проведение опыта по адсорбции.
Чтобы увеличить поглотительную способность, древесный
уголь обрабатывают горячим водяным паром. Такой уголь называют активированным.
В аптеках его продают в виде черных таблеток- карболена.
-С какой целью используют активированный уголь в медицине и почему?
Слайд 23
VII. Физминутка:
А теперь, ребята, встать,
Руки медленно поднять,
Пальцы сжать,
потом разжать,
Руки вниз, и так стоять.
Наклонитесь вправо, влево,
И беритесь
вновь за дело.
Слайд 24
VIII. Химические свойства углерода.
Учитель: мы знаем, что аллотропные
модификации одного и того же элемента могут переходить друг
в друга. А как алмаз перевести в уголь?
Обучающиеся: сжечь.
Учитель: действительно алмаз можно сжечь. В первые это сделали в 1694 г, при помощи большого зажигательного стекла, английские ученые Деви и Фарадей.. Горел алмаз ослепительным пламенем. Запишите уравнение этой реакции и рассмотрите с позиций окисления-восстановления. ( 1 учащийся выполняет у доски.) Какую роль здесь выполняет углерод?
4 1
4 1
Обучающиеся: восстановитель
Слайд 25
Учитель: С какими элементами будет взаимодействовать углерод в
качестве окислителя?
Обучающиеся: с металлами.
Учитель: приведите пример и рассмотрите как
окислительно-восстановительную реакцию. (С последующей проверкой у доски, взаимодействие углерода с алюминием.) Дайте название продукту реакции.
Обучающиеся: карбид алюминия.
4
3
Слайд 26
Учитель: соединения с углеродом называются карбиды. Карбид алюминия
представляет собой желтые кристаллы. Если на него подействовать водой
то получится метан. Вам более известен карбид кальция, в виде кусочков серого цвета. Его применяют газосварщики для получения ацетилена, используемого для резки и сварки металлов.
Какие области применения углерода вы знаете?
Обучающиеся: для восстановления металлов из их оксидов.
Слайд 27
Лабораторный опыт «Восстановление меди из ее оксида углеродом»:
1.
В пробирку с оксидом меди (II) всыпать измельченный уголь.
Встряхнуть.
2. Закрыть пробирку пробкой с газоотводной трубкой. Укрепить пробирку в лапке штатива. Конец газоотводной трубки опустить в пробирку с известковой водой.
3. Нагреть смесь оксида меди (II) и угля на спиртовке.
4. Какие изменения происходят с известковой водой? Почему?
5. Какие изменения произошли в пробирке? Запишите уравнение реакции.
Учитель: какую роль в этой реакции выполняет углерод? По каким признакам вы определили, что реакция завершилась?
Обучающиеся: окислителя, выделилась медь красного цвета.
Учитель: при высокой температуре и давлении из графита можно получить алмаз.
Слайд 28
10. Круговорот углерода в природе.
Слайд 29
Учитель: вспомните, где в природе встречается углерод?
В земной

коре углерода примерно 0,35 % по массе. В природе
встречается в свободном и связанном состоянии, главным образом в виде карбонатов ( мел, мрамор, известняк), в каменном (99 %)и буром (72 %)углях, торфе (57%); входит в состав нефти, природного газа, растений , организмов человека и животных. Его соединения составляют основу живой природы. Атомы углерода могут соединяться разнообразными способами между собой и с атомами других элементов, образуя огромное разнообразие веществ.
Их химические связи могут возникать и разрушаться под действием различных факторов. Так возникает круговорот углерода в природе. Из атмосферы и природных вод углекислый газ поглощается зелеными растениями, а в результате процессов дыхания, брожения, гниения снова поступает в атмосферу и воды морей и океанов. Добываемые из недр земли уголь, нефть и другие углеродсодержащие горючие ископаемые при сжигании выделяют углекислый газ, поступающий в атмосферу. При разрушении горных пород , содержащиеся в них металлы, при действии атмосферного углекислого газа образуют осаждающиеся карбонаты.
Слайд 30
11. Выполнение тестовых заданий. Взаимопроверка.
1. Аллотропным видоизменением углерода
не является:
Алмаз
Карбин
Аморфный углерод
2. Причина различия свойств алмаза и графита:
Строение
кристаллической решетки
Количество атомов
Цвет
3. Ученый, открывший явление адсорбции:
Марковников
Ловиц
Фарадей
4. Фильтрующий противогаз впервые разработал:
Менделеев
Кюри
Зелинский
5. Углерод проявляет свойства:
Окислительно-восстановительные
Только окислительные
Только восстановительные
6. В данной реакции 2C + Ca = CaC2 углерод проявляет свойства:
Окислителя
Восстановителя
Оба ответа верны