Слайд 2
Физические и физико-химические свойства
Молекула имеет плоскую структуру (длины
связей в нм):
азот в азотной кислоте четырёхвалентен, степень
окисления +5.
азотная кислота - бесцветная, дымящая на воздухе жидкость,
концентрированная азотная кислота обычно окрашена в желтый цвет,
(высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
4HNO3 == 4NO2 + 2H2O + O2 )
температура плавления -41,59°С,
кипения +82,6°С с частичным разложением.
растворимость азотной кислоты в воде неограничена. В водных растворах она практически полностью диссоциирует на ионы. С водой образует азеотропную смесь.
Слайд 3
Химические свойства
При нагревании азотная кислота распадается по той
же реакции.
4HNO3 == 4NO2 + 2H2O +
O2 )
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
CuO + 2HNO3 = Cu(NO3)2 + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
б) с основаниями:
KOH + HNO3 = KNO3 + H2O
в) вытесняет слабые кислоты из их солей:
CaCO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2
При кипении или под действием света азотная кислота частично разлагается:
4HNO3 = 4NO2 + O2 + 2H2O
Слайд 4
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя,

при этом азот восстанавливается до степени окисления от +4
до -3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты.
Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
Cu + 4HNO3(60%) = Cu(NO3)2 + 2NO2 + 2H2O
Разбавленная HNO3
3Cu + 8HNO3(30%) = 3Cu(NO3)2 + 2NO + 4H2O
б) с металлами, стоящими в ряду напряжений левее водорода:
Zn + 4HNO3(60%) = Zn(NO3)2 + 2NO2 + 2H2O
3Zn + 8HNO3(30%) = 3Zn(NO3)2 + 2NO + 4H2O
4Zn + 10HNO3(20%) = 4Zn(NO3) 2 + N2O + 5H2O
5Zn + 12HNO3 = 5Zn(NO3) 2 + N2 + 6H2O д
4Zn + 10HNO3(3%) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Слайд 5
Нитраты
HNO3 — сильная кислота. Её соли — нитраты — получают действием
HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты
хорошо растворимы в воде.
Соли азотной кислоты - нитраты - при нагревании необратимо разлагаются, продукты разложения определяются катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
2NaNO3 = 2NaNO2 + O2
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
2AgNO3 = 2Ag + 2NO2 + O2
г) нитрат аммония:
NH4NO3 = N2O + 2H2O
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии нитраты - сильные окислители, например:
Fe + 3KNO3 + 2KOH = K2FeO4 + 3KNO2 + H2O - при сплавлении твердых веществ.
Слайд 6
Соли азотной кислоты — нитраты — широко используются как удобрения.
При этом практически все нитраты хорошо растворимы в воде,
поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
С азотной кислотой не реагируют стекло, фторопласт-4.
Слайд 7
Производство азотной кислоты
Промышленное производство.
Современный способ её производства основан
на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах до
смеси оксидов азота, с дальнейшим поглощением их водой
Промышленный способ получения HNO3 состоит из следующих основных стадий:
1. окисления аммиaка в NO в присутствии платино-родиевого
катализатора:
4NH3 + 5O2 = 4NO + 6H2O
2. окисления NO в NO2 на холоду под давлением (10 ат, 1 МПа):
2NO + O2 = 2NO2
3. поглощения NO2 водой в присутствии кислорода:
4NO2 + 2H2O + O2= 4HNO3
Массовая доля HNO3 в получаемом растворе составляет около 0,6.
Изредка применяемый дуговой способ получения азотной кислоты отличается только первой стадией, которая состоит в пропускании воздуха через пламя электрической дуги:
N2 + O2 = 2NO
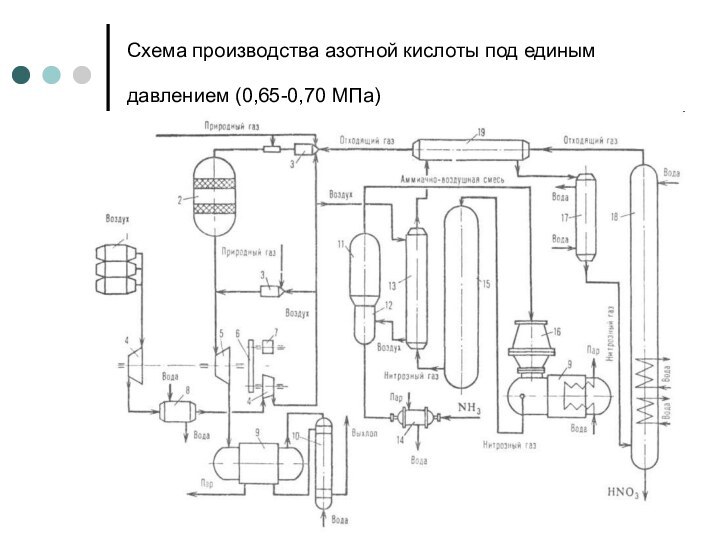
Слайд 8
Схема производства азотной кислоты под единым давлением (0,65-0,70
МПа)
Слайд 9
Лабораторный способ получения HNO3
Действие концентрированной серной кислоты
на твердые нитраты при нагревании:
NaNO3 + H2SO4 = NaHSO4
+ HNO3
при этом получается дымящая азотная кислота.
Слайд 10
Впервые азотную кислоту получили алхимики, нагревая смесь селитры
и железного купороса:
4KNO3 + 2(FeSO4 · 7H2O) (t°) →
Fe2O3 + 2K2SO4 + 2HNO3↑ + NO2↑ + 13H2O
Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
KNO3 + H2SO4(конц.) (t°) → KHSO4 + HNO3↑
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
Слайд 11
Применение
лекарства
в производстве взрывчатых и отравляющих веществ
красители
в фотографии — подкисление
некоторых тонирующих растворов
в производстве минеральных удобрений