- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Спирты (10класс)
Содержание
- 2. КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯСпирты Альдегиды УглеводыКарбоновые кислоты Жиры ЭфирыСпирты (алкоголи)
- 3. Спиртами называют производные углеводородов, в молекулах которых
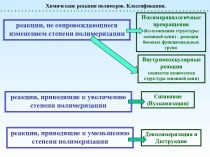
- 4. Классификация спиртов 1. По числу гидроксильных групп
- 5. Спирты
- 6. НОМЕНКЛАТУРА СПИРТОВсистематические названия спиртов даются по названию
- 7. Изомерия и номенклатура изомерия положения ОН –
- 8. СТРОЕНИЕСН3 – СН = СН – СН2 – ОНВиды гибридизации атомов углерода?Виды химических связей?
- 9. Физические свойства Следствием полярности связи О–Н и
- 10. СН3 – ОН метанолС2Н5 – ОН этанолС3Н7
- 11. Химические свойства спиртов 1. Реакции замещения водорода
- 12. Реакции замещения ВОДОРОДА в функциональной группе Одноатомные
- 13. Реакции замещения группы -ОН Замещение гидроксильной группы
- 14. Реакции дегидратации Внутримолекулярная дегидратация спиртов с образованием
- 15. Образование сложных эфиров Спирты взаимодействуют с нерганическими
- 16. Реакции окисления При действии окислителей Первичные спирты
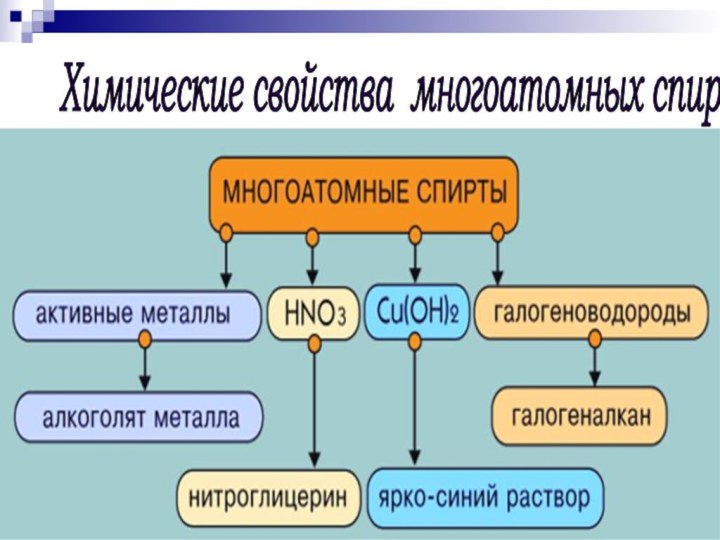
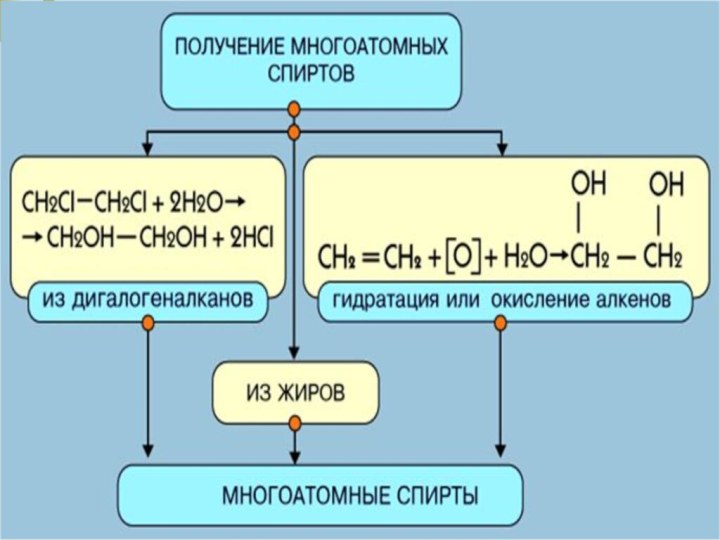
- 17. Химические свойства многоатомных спиртов
- 19. Получение спиртов Метанол
- 21. Применение спиртов Метанол CH3OH -производство формальдегида, муравьиной
- 22. Скачать презентацию
- 23. Похожие презентации
КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯСпирты Альдегиды УглеводыКарбоновые кислоты Жиры ЭфирыСпирты (алкоголи)











Слайд 3 Спиртами называют производные углеводородов, в молекулах которых один
или несколько атомов водорода замещены гидроксильными группами.
СН3 – ОН
метанолС2Н5 – ОН этанол
С3Н7 – ОН пропанол
С4Н9 – ОН бутанол
С5Н11 – ОН пентанол
R - OH
R углеводородный
радикал
ОН – гидрокильная
группа
Слайд 4
Классификация спиртов
1. По числу гидроксильных групп спирты
подразделяются на одноатомные (одна группа -ОН) и многоатомные (две
и более групп -ОН).Примеры:
двухатомный спирт – этиленгликоль (этандиол -1,2)
HO–СH2–CH2–OH
трехатомный спирт – глицерин (пропантриол-1,2,3)
HO–СH2–СН(ОН)–CH2–OH
2. По строению радикалов, связанных с атомом кислорода, различают спирты:
предельные, или алканолы (например, СH3 - CH2–OH)
непредельные, или алкенолы (CH2=CH–CH2–OH)
ароматические (C6H5CH2–OH).
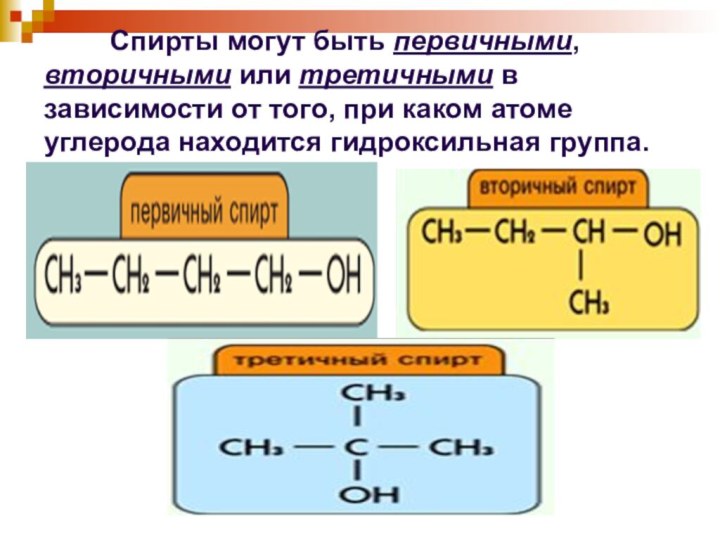
Слайд 5 Спирты могут
быть первичными, вторичными или третичными в зависимости от того,
при каком атоме углерода находится гидроксильная группа.
Слайд 6
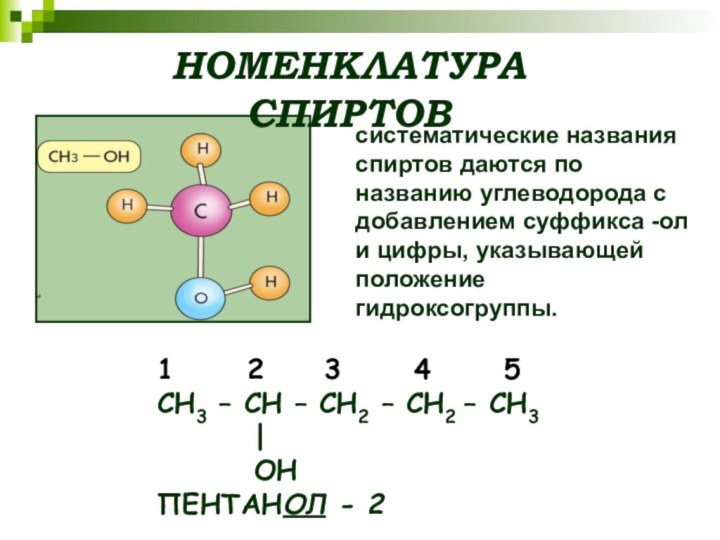
НОМЕНКЛАТУРА СПИРТОВ
систематические названия спиртов даются по названию углеводорода
с добавлением суффикса -ол и цифры, указывающей положение гидроксогруппы.
1
2 3 4 5СН3 – СН – СН2 – СН2 – СН3
|
ОН
ПЕНТАНОЛ - 2
Слайд 7
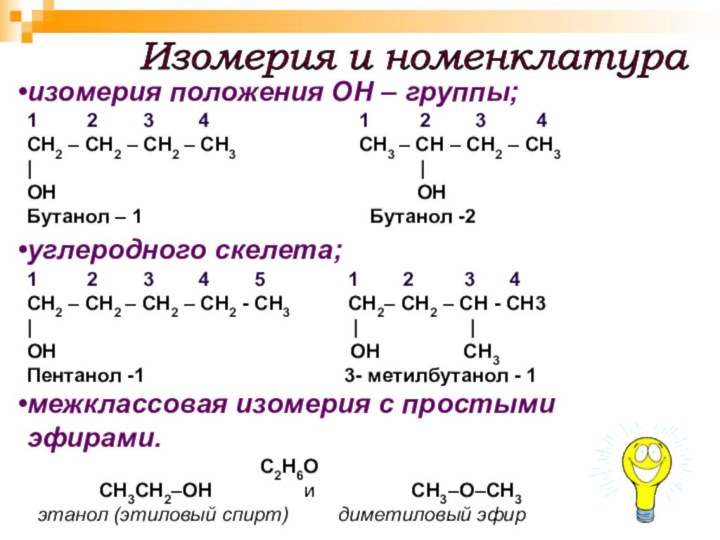
Изомерия и номенклатура
изомерия положения ОН – группы;
1 2
3 4 1 2 3 4 СН2 – СН2 – СН2 – СН3 СН3 – СН – СН2 – СН3
| |
ОН ОН
Бутанол – 1 Бутанол -2
углеродного скелета;
1 2 3 4 5 1 2 3 4
СН2 – СН2 – СН2 – СН2 - СН3 СН2– СН2 – СН - СН3
| | |
ОН ОН СН3
Пентанол -1 3- метилбутанол - 1
межклассовая изомерия с простыми эфирами.
С2H6O
СН3CH2–OH и CH3–O–CH3
этанол (этиловый спирт) диметиловый эфир
Слайд 9
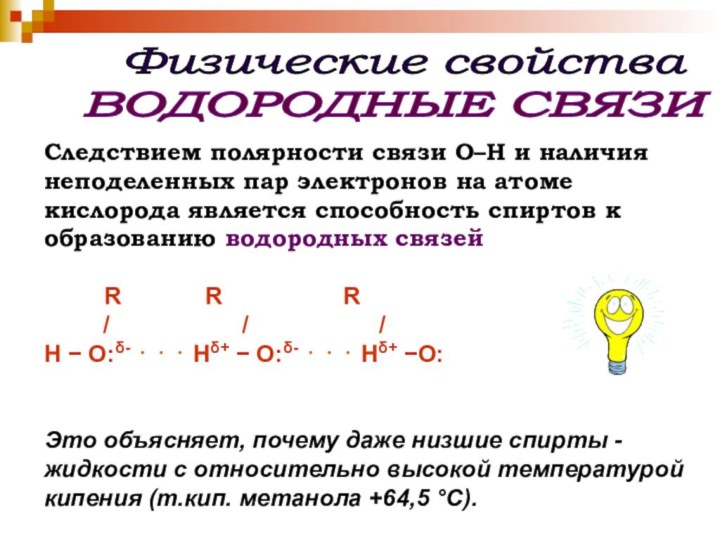
Физические свойства
Следствием полярности связи О–Н и наличия
неподеленных пар электронов на атоме кислорода является способность спиртов
к образованию водородных связейR R R
/ / /
H − O:δ- ⋅ ⋅ ⋅ Hδ+ − O:δ- ⋅ ⋅ ⋅ Hδ+ −O:
Это объясняет, почему даже низшие спирты - жидкости с относительно высокой температурой кипения (т.кип. метанола +64,5 °С).
ВОДОРОДНЫЕ СВЯЗИ
Слайд 10
СН3 – ОН метанол
С2Н5 – ОН этанол
С3Н7 –
ОН пропанол
С4Н9 – ОН бутанол
……….
С10Н21 – ОН деканол
R -
OHФизические свойства
Ж, Ц, Р в Н2О, ЯД,
З (алкогольный),
В (жгучий)
Высшие спирты
с С12Н25ОН Тв.
☠
Слайд 11
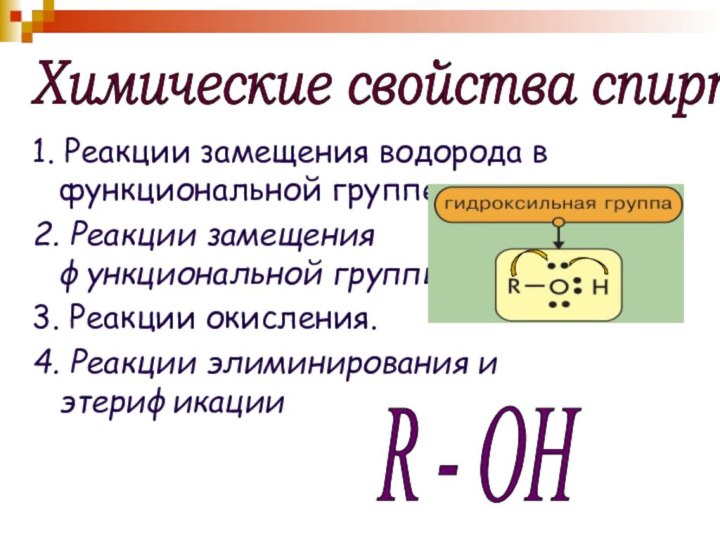
Химические свойства спиртов
1. Реакции замещения водорода в
функциональной группе.
2. Реакции замещения функциональной группы.
3. Реакции окисления.
4. Реакции
элиминирования и этерификацииR - OH
Слайд 12
Реакции замещения ВОДОРОДА в функциональной группе
Одноатомные спирты
реагируют с активными металлами, (проявляя кислотные свойства), образуя соли
- алкоголяты:2R–OH + 2K → 2RO– K + H2
2C2H5OH + 2Na → 2C2H5O– Na + H2
этилат натрия
Слайд 13
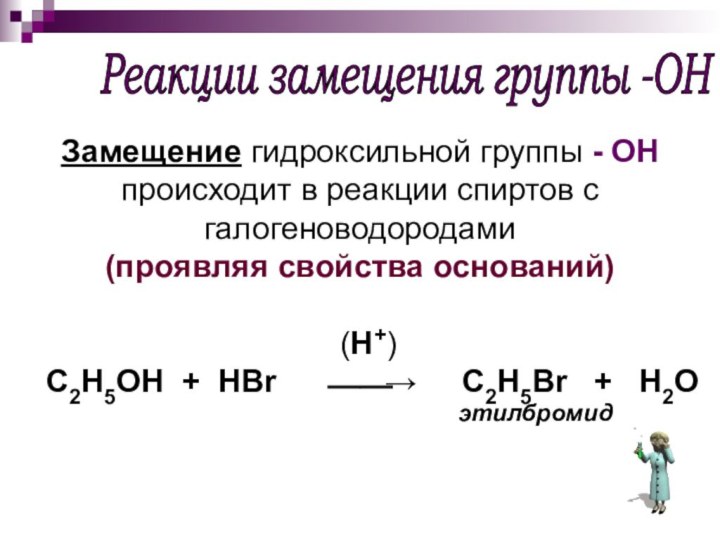
Реакции замещения группы -ОН
Замещение гидроксильной группы -
ОН происходит в реакции спиртов с галогеноводородами
(проявляя свойства оснований)
(H+)
C2H5OH + HBr ⎯⎯→ C2H5Br + H2O
этилбромид
Слайд 14
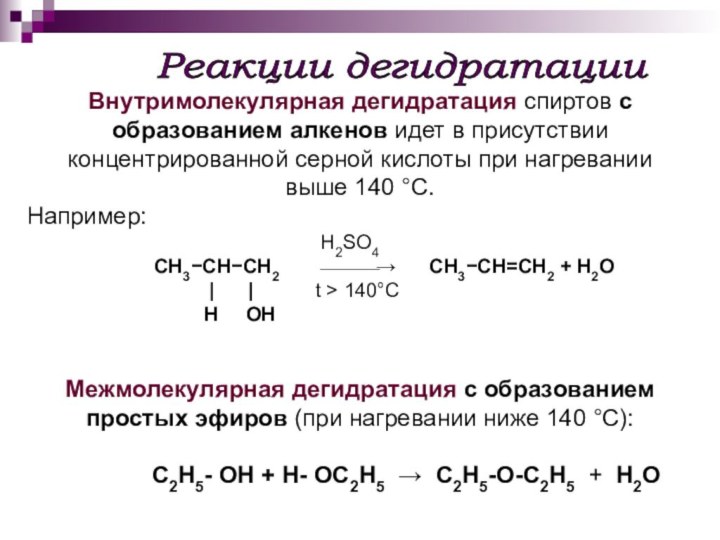
Реакции дегидратации
Внутримолекулярная дегидратация спиртов с образованием алкенов
идет в присутствии концентрированной серной кислоты при нагревании
выше
140 °С. Например:
H2SO4
CH3−CH−CH2 ⎯⎯⎯→ CH3−CH=CH2 + H2O
| | t > 140°C
H OH
Межмолекулярная дегидратация с образованием простых эфиров (при нагревании ниже 140 °С):
C2H5- OH + H- OC2H5 → C2H5-O-C2H5 + H2O
Слайд 15
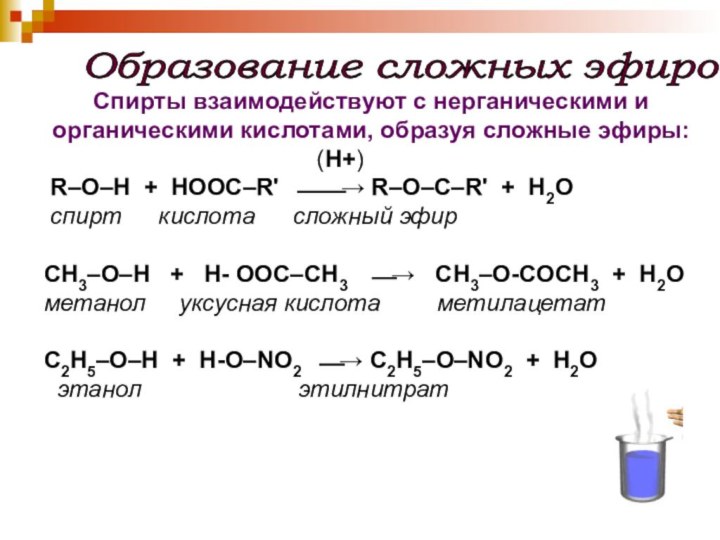
Образование сложных эфиров
Спирты взаимодействуют с нерганическими и
органическими кислотами, образуя сложные эфиры:
(H+)R–O–H + HOОC–R' ⎯⎯→ R–O–C–R' + H2O
спирт кислота сложный эфир
CH3–O–H + H- OОС–CH3 ⎯→ CH3–O-СOCH3 + H2O
метанол уксусная кислота метилацетат
C2H5–O–H + H-O–NO2 ⎯→ C2H5–O–NO2 + H2O
этанол этилнитрат
Слайд 16
Реакции окисления
При действии окислителей
Первичные спирты образуют
альдегиды, которые затем легко окисляются до карбоновых кислот:
[O] [O]R–СН2–OH ⎯⎯→ R–СOН ⎯⎯→ R–СOOH
-H2O альдегид карбоновая кислота
При окислении вторичных спиртов образуются кетоны:
[O]
R−CH−R' ⎯⎯→ R−C−R'
| -H2O ||
OH O
РЕАКЦИЯ ГОРЕНИЕ (горят синим пламенем)
СПИРТ + О2 → СО2 + Н2О
С2Н5ОН + 3О2 → 2СО2 + 3Н2О
Слайд 19
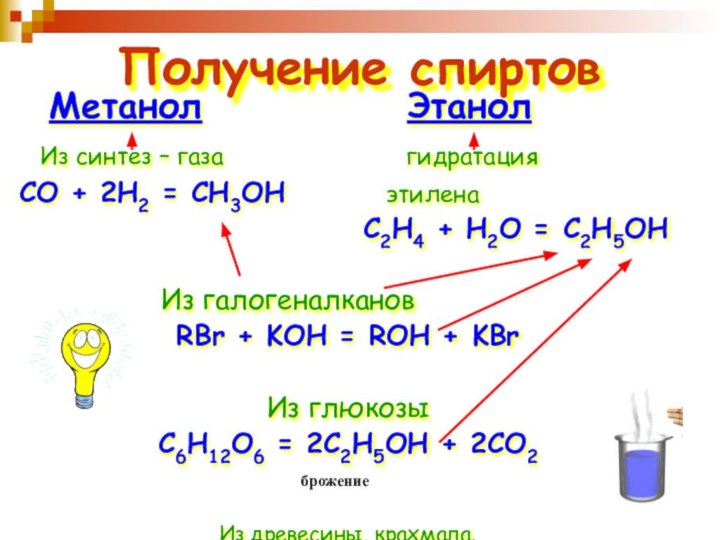
Получение спиртов
Метанол
Этанол
Из
синтез – газа гидратация СО + 2Н2 = СН3ОН этилена
С2Н4 + Н2О = С2Н5ОН
Из галогеналканов
RBr + KOH = ROH + KBr
Из глюкозы
C6H12O6 = 2С2Н5ОН + 2CO2
Из древесины, крахмала.
брожение
Слайд 21
Применение спиртов
Метанол CH3OH
-производство формальдегида, муравьиной кислоты;
- растворитель.
Этанол С2Н5ОН (этиловый спирт)
- производство ацетальдегида, уксусной
кислоты, бутадиена,простых и сложных эфиров;
- растворитель для красителей, лекарственных и парфюмерных средств;
- производство ликеро-водочных изделий;
- дезинфицирующее средство в медицине;
- горючее для двигателей, добавка к моторным топливам.