- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
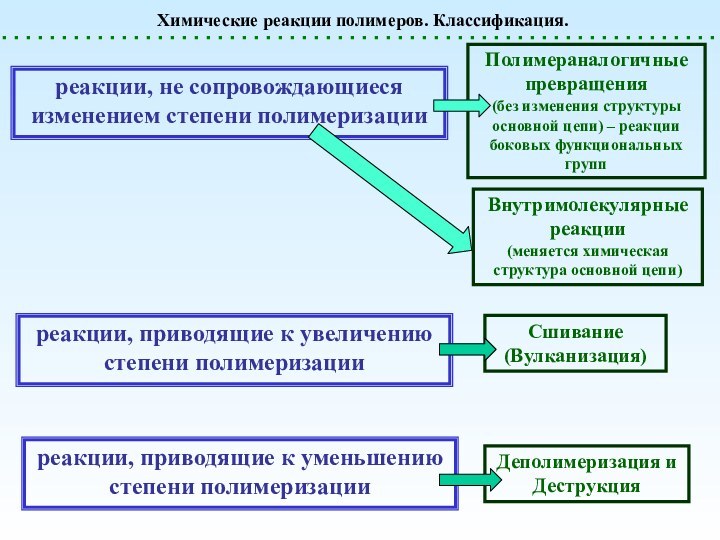
Презентация на тему Химические реакции полимеров. Классификация
Содержание
- 2. Полимераналогичные превращения. Примеры. 1. Изменение свойств уже существующих полимеров. Пример: модификация целлюлозы ДинитроцеллюлозаТринитроцеллюлоза+ КамфораЦеллюлоид
- 3. Полимераналогичные превращения. Примеры. 2. Получение полимеров, которые
- 4. Полимераналогичные превращения. Эффект соседа. Полимераналогичную реакцию можно
- 5. Полимераналогичные превращения. Эффект соседа. ln[A]t«Эффект соседа» отсутствуетЗамедляющий
- 6. Полимераналогичные превращения. Нет эффект соседа. Пример. «Эффект
- 7. Полимераналогичные превращения. Ускоряющий эффект соседа. Пример. «Ускоряющий
- 8. Полимераналогичные превращения. Замедляющий эффект соседа. Пример. «Замедляющий
- 9. Полимераналогичные превращения. Другие полимерные эффекты На скорость
- 10. Конформационный эффект. Щелочной гидролиз поливинилацетатаРастворитель – вода - ацетонИзменяется качество растворителя изменяется конформация макромолекул
- 11. Конфигурационный эффектПиролиз полиметакриловой кислотыизо-тактическаясиндио-тактическаяатактическая?
- 12. Электростатический эффектЩелочной гидролиз полиакрилатов /NaOH, H2O+ацетонизо-тактическийсиндио-тактическийатактический?концентрация ОН-?конфигурацонный эффект + электростатический эффект
- 13. Надмолекулярный эффект Окисление полипропиленаСкорость уменьшается при предварительной
- 14. Концентрационный эффект кислотный гидролиз в присутствии полистиролсульфокислотысложный
- 15. Внутримолекулярные реакции. Примеры. Внутримолекулярные реакции – реакции,
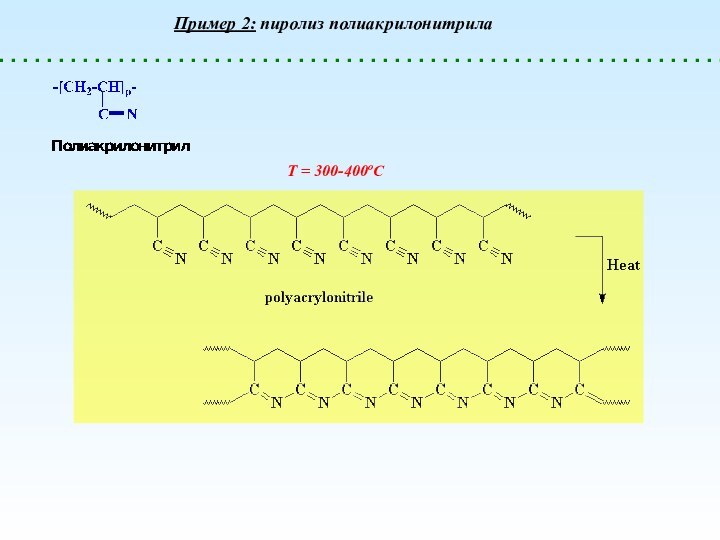
- 16. Т = 300-400оСПример 2: пиролиз полиакрилонитрила
- 17. Пиролиз полиакрилонитрила.. Т = 600-700оС+ H2Т =
- 18. Реакции сшивания (вулканизации). ПримерыПример 1: вулканизация полибутадиенового
- 19. Реакции сшивания (вулканизации). ПримерыПример 2: Вулканизация полиэтилена
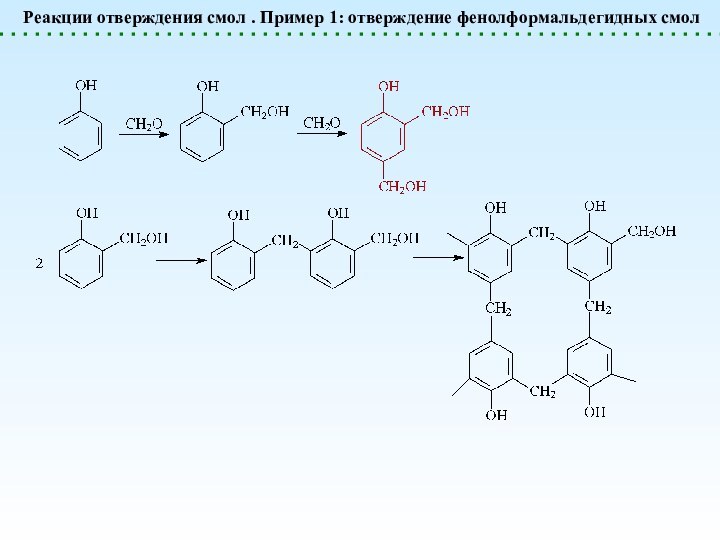
- 20. Реакции отверждения смол . Пример 1: отверждение фенолформальдегидных смол
- 21. Реакции отверждения смол . Пример 2: отверждение
- 22. Реакции отверждения смол . Пример 2: отверждение эпоксидных смол Стадия вторая: сшивание молекул форполимера диаминами.
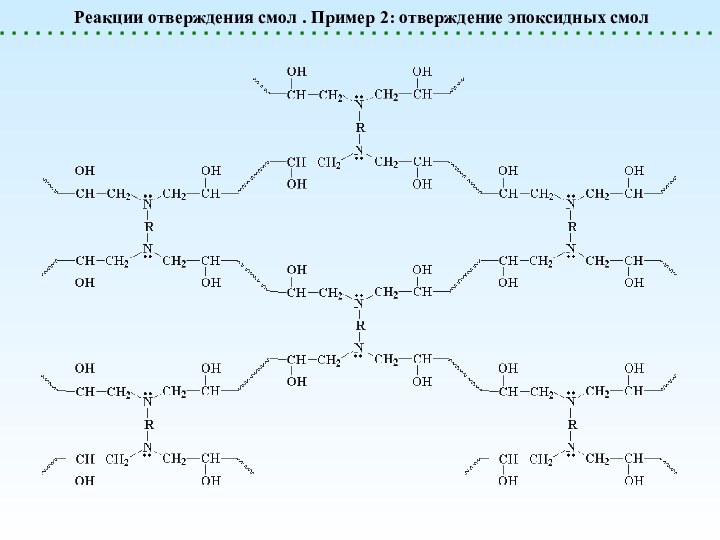
- 23. Реакции отверждения смол . Пример 2: отверждение эпоксидных смол
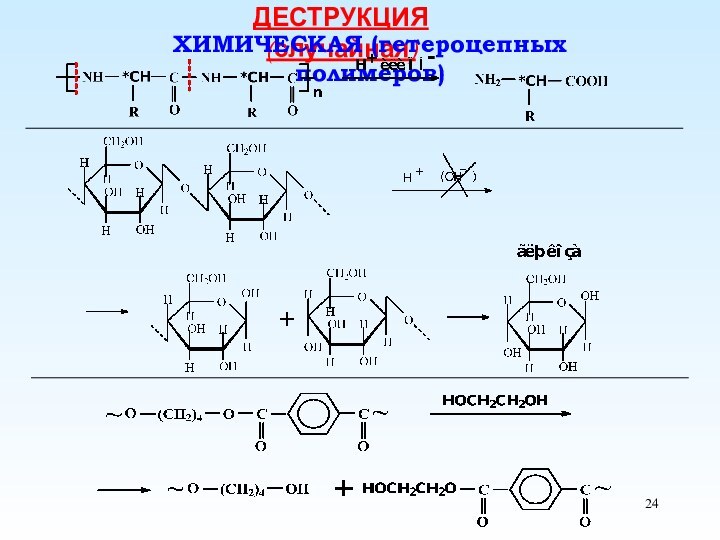
- 24. ДЕСТРУКЦИЯ (случайная)ХИМИЧЕСКАЯ (гетероцепных полимеров)
- 25. Реакции деполимеризации. На примере полиметилметакрилата.Т 220оСМеханизм
- 26. Деполимеризация полиметилметакрилата: механизм.I. Инициирование (образование свободных радикалов):II. Развитие цепи (собственно деполимеризация):
- 27. Деполимеризация полиметилметакрилата: механизм.II. Обрвыв цепи (гибель свободных
- 28. Термическая деструкция полиметилакрилата: механизм.Реакция деполимеризации протекаетНо конкурирующая реакция передачи цепи на полимер протекает МНОГО БЫСТРЕЕ
- 29. Термическая деструкция полиметилакрилата: механизм.Произошла реакция деструкции: цепь
- 30. Термолиз различных полимеров и выход мономера-[CH2-CH2]p--[CF2-CF2]p-
- 31. Термоокислительная деструкция полимеровСамозарождение цепи – при обычных
- 32. Термоокислительная деструкция полимеровIII. Разветвление цепи:IV. Стадия деструкции:
- 33. Термоокислительная деструкция полимеровОбразование свободных радикалов в полимере
- 34. Скачать презентацию
- 35. Похожие презентации
![Химические реакции полимеров. Классификация Полимераналогичные превращения. Эффект соседа. ln[A]t«Эффект соседа» отсутствуетЗамедляющий «эффект соседа» Ускоряющий «эффект соседа»](/img/tmb/14/1383379/c0b2235a68804b7ef63bfd560ca067cd-720x.jpg)



![Химические реакции полимеров. Классификация Термолиз различных полимеров и выход мономера-[CH2-CH2]p--[CF2-CF2]p-](/img/tmb/14/1383379/0169463d3a4fd74d7bc0e47590542199-720x.jpg)
Слайд 2
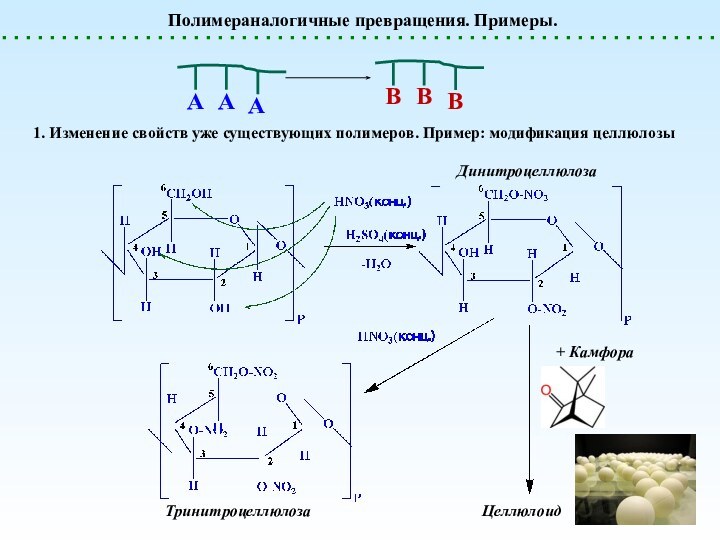
Полимераналогичные превращения. Примеры.
1. Изменение свойств уже существующих
полимеров. Пример: модификация целлюлозы
Слайд 3
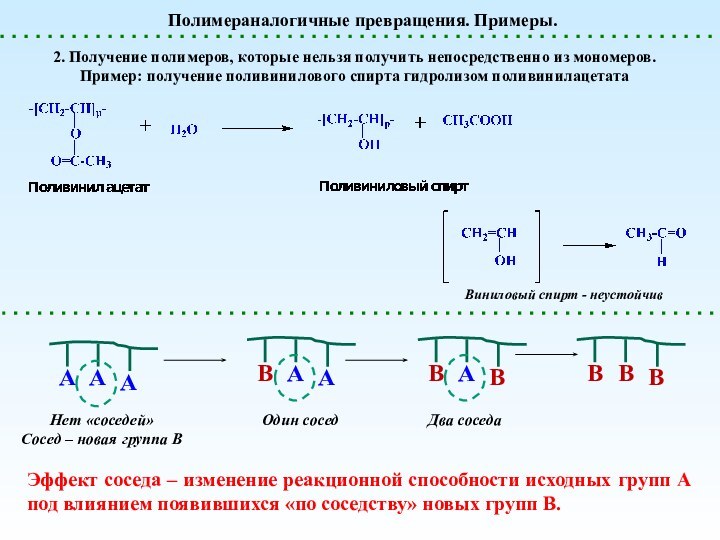
Полимераналогичные превращения. Примеры.
2. Получение полимеров, которые нельзя
получить непосредственно из мономеров.
Пример: получение поливинилового спирта гидролизом
поливинилацетатаВиниловый спирт - неустойчив
Нет «соседей»
Сосед – новая группа В
Один сосед
Два соседа
Эффект соседа – изменение реакционной способности исходных групп А под влиянием появившихся «по соседству» новых групп В.
Слайд 4
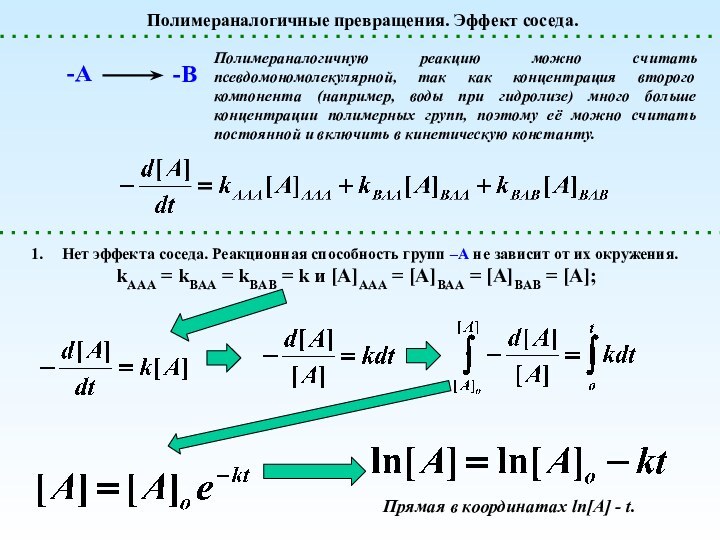
Полимераналогичные превращения. Эффект соседа.
Полимераналогичную реакцию можно считать
псевдомономолекулярной, так как концентрация второго компонента (например, воды при
гидролизе) много больше концентрации полимерных групп, поэтому её можно считать постоянной и включить в кинетическую константу.Нет эффекта соседа. Реакционная способность групп –А не зависит от их окружения.
kAAA = kBAA = kBAB = k и [A]AAA = [A]BAA = [A]BAB = [A];
Прямая в координатах ln[A] - t.
Слайд 5
Полимераналогичные превращения. Эффект соседа.
ln[A]
t
«Эффект соседа» отсутствует
Замедляющий «эффект
соседа»
Ускоряющий «эффект соседа»
2. Ускоряющий эффект соседа. Появление
соседних групп –В увеличивает скорость реакции превращения групп –А в –В.kAAA < kBAA < kBAB
3. Замедляющий эффект соседа. Появление соседних групп –В замедляет скорость реакции превращения групп –А в –В.
kAAA > kBAA > kBAB
Слайд 6
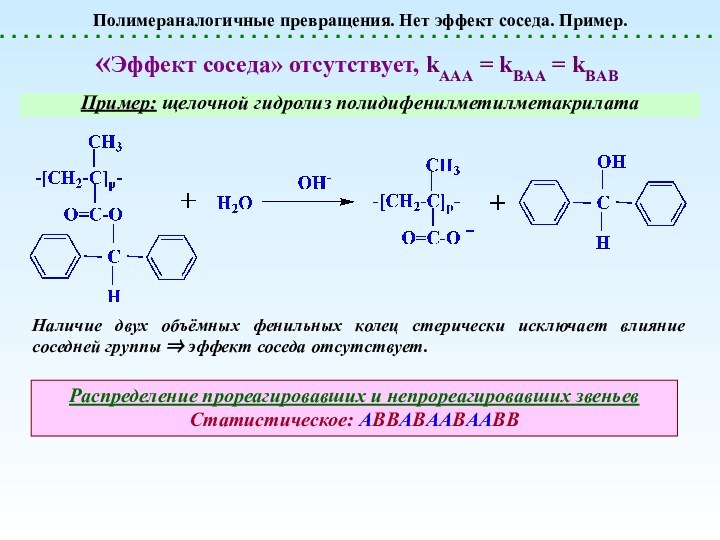
Полимераналогичные превращения. Нет эффект соседа. Пример.
«Эффект соседа»
отсутствует, kAAA = kBAA = kBAB
Пример: щелочной гидролиз полидифенилметилметакрилата
Наличие двух объёмных фенильных колец стерически исключает влияние соседней группы эффект соседа отсутствует.
Распределение прореагировавших и непрореагировавших звеньев
Статистическое: АВВАВААВААВВ
Слайд 7
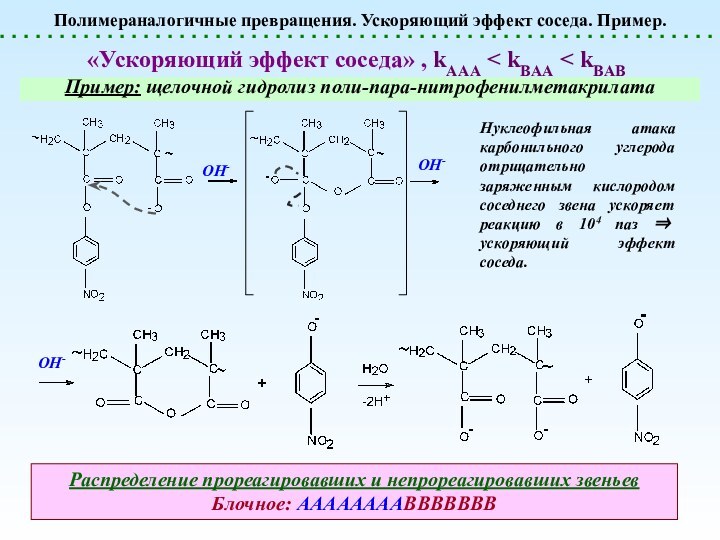
Полимераналогичные превращения. Ускоряющий эффект соседа. Пример.
«Ускоряющий эффект
соседа» , kAAA < kBAA < kBAB
Пример: щелочной гидролиз
поли-пара-нитрофенилметакрилата Нуклеофильная атака карбонильного углерода отрицательно заряженным кислородом соседнего звена ускоряет реакцию в 104 паз ускоряющий эффект соседа.
Распределение прореагировавших и непрореагировавших звеньев
Блочное: ААААААААВВВВВВВ
OH-
OH-
OH-
Слайд 8
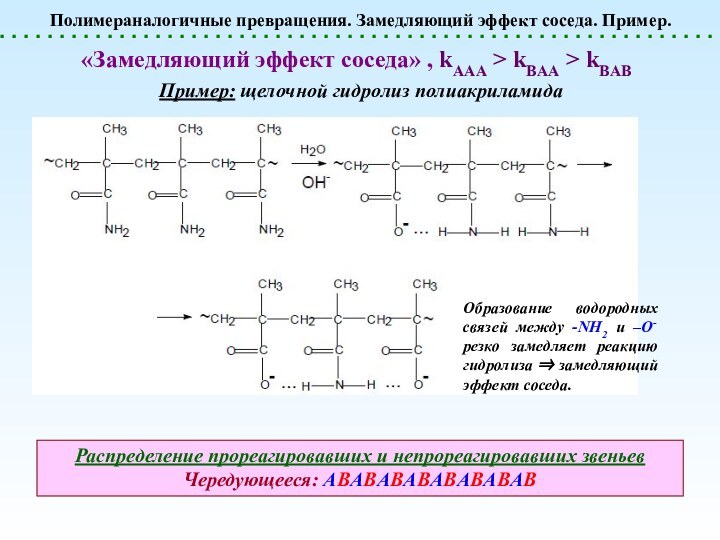
Полимераналогичные превращения. Замедляющий эффект соседа. Пример.
«Замедляющий эффект
соседа» , kAAA > kBAA > kBAB
Пример: щелочной гидролиз
полиакриламида Распределение прореагировавших и непрореагировавших звеньев
Чередующееся: АВАВАВАВАВАВАВАВ
Образование водородных связей между -NH2 и –O- резко замедляет реакцию гидролиза замедляющий эффект соседа.
Слайд 9
Полимераналогичные превращения. Другие полимерные эффекты
На скорость полимераналогичных
превращений могут оказывать другие полимерные эффекты:
Конформационный эффект (гидролиз поливиниацетата,
фепментативный катализ);Конфигурационный эффект (различие в реакционной способности изо- и синдио- изомеров);
Надмолекулярный эффект (гидратированная и негидратированная целлюлоза), аморфные и кристаллические области полимеров и др.
Другие (концентрационный, электростатический)
Слайд 10
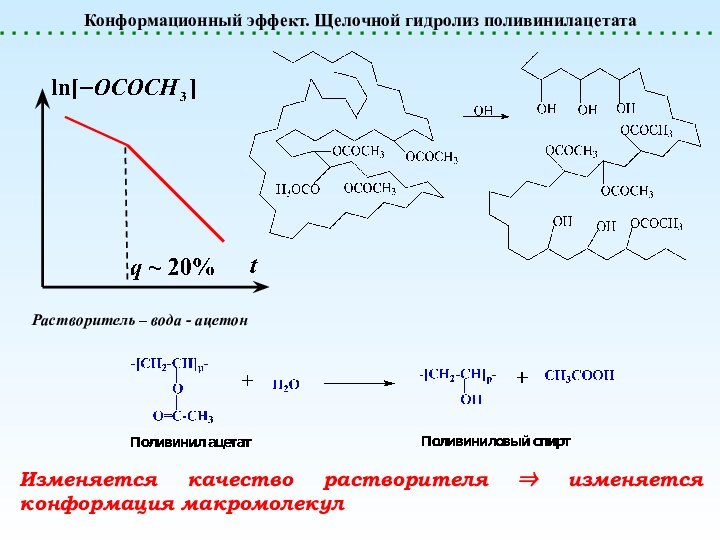
Конформационный эффект. Щелочной гидролиз поливинилацетата
Растворитель – вода -
ацетон
Изменяется качество растворителя изменяется конформация макромолекул
Слайд 11
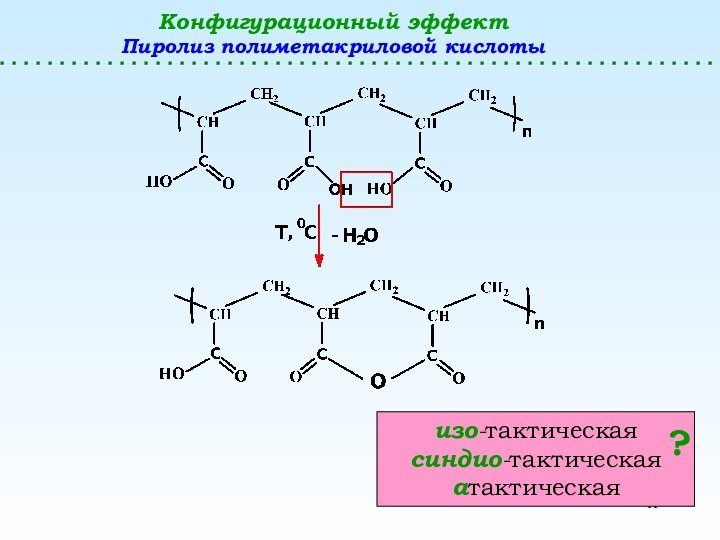
Конфигурационный эффект
Пиролиз полиметакриловой кислоты
изо-тактическая
синдио-тактическая
атактическая
?
Слайд 12
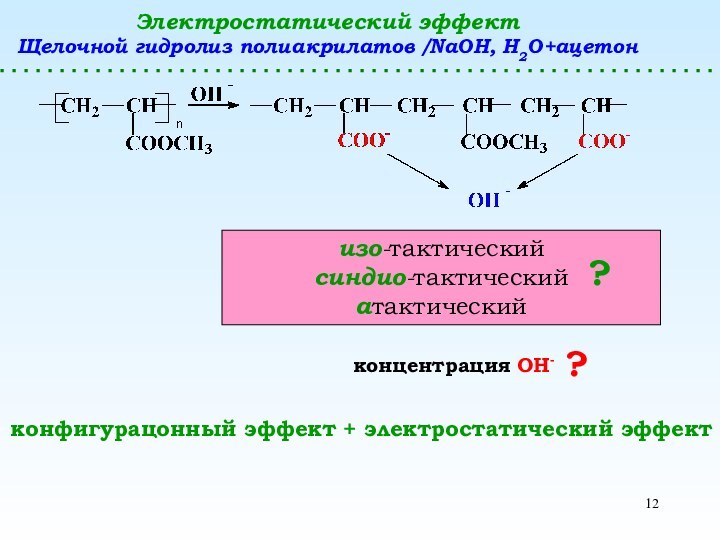
Электростатический эффект
Щелочной гидролиз полиакрилатов /NaOH, H2O+ацетон
изо-тактический
синдио-тактический
атактический
?
концентрация ОН-
?
конфигурацонный эффект
+ электростатический эффект
Слайд 13
Надмолекулярный эффект
Окисление полипропилена
Скорость уменьшается при предварительной ориентации
полимера
Хлорирование полиэтилена в твердой фазе
Скорость реакции в аморфных
участках выше, чем в кристаллическихРезультатом надмолекулярного эффекта является композиционная неоднородность продуктов полимераналогичных превращений
Слайд 14
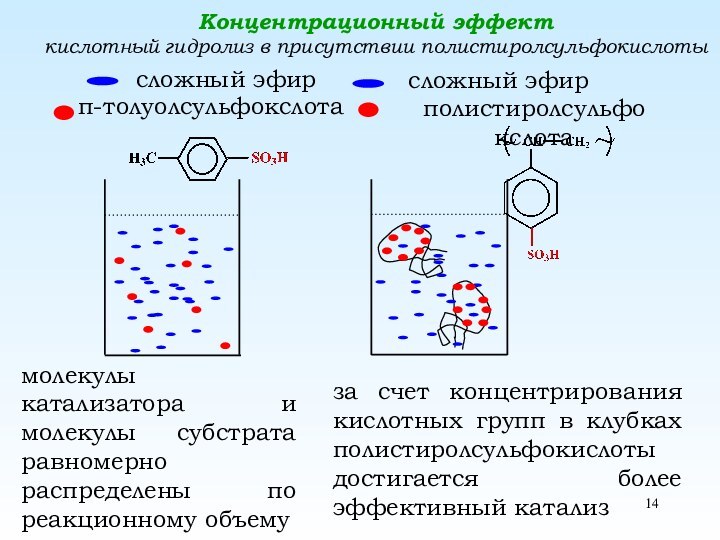
Концентрационный эффект
кислотный гидролиз в присутствии полистиролсульфокислоты
сложный эфир
п-толуолсульфокслота
сложный
эфир
полистиролсульфокслота
молекулы катализатора и молекулы субстрата равномерно распределены по реакционному
объему за счет концентрирования кислотных групп в клубках полистиролсульфокислоты достигается более эффективный катализ
Слайд 15
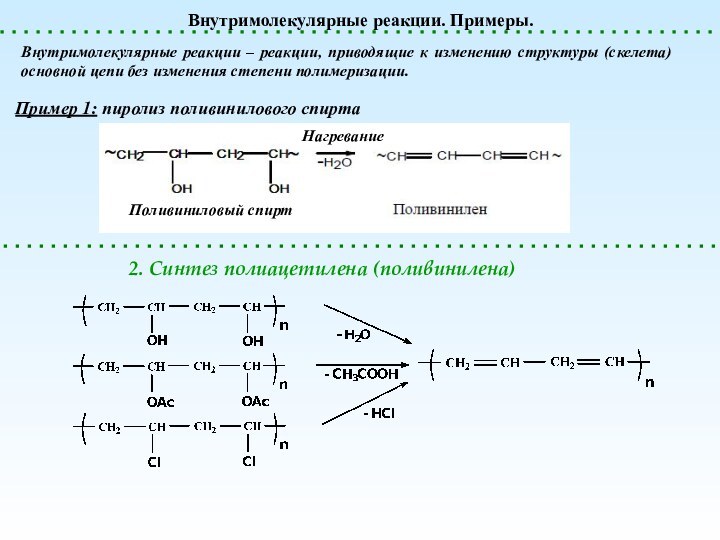
Внутримолекулярные реакции. Примеры.
Внутримолекулярные реакции – реакции, приводящие
к изменению структуры (скелета) основной цепи без изменения степени
полимеризации.Пример 1: пиролиз поливинилового спирта
Поливиниловый спирт
Нагревание
2. Синтез полиацетилена (поливинилена)
Слайд 17
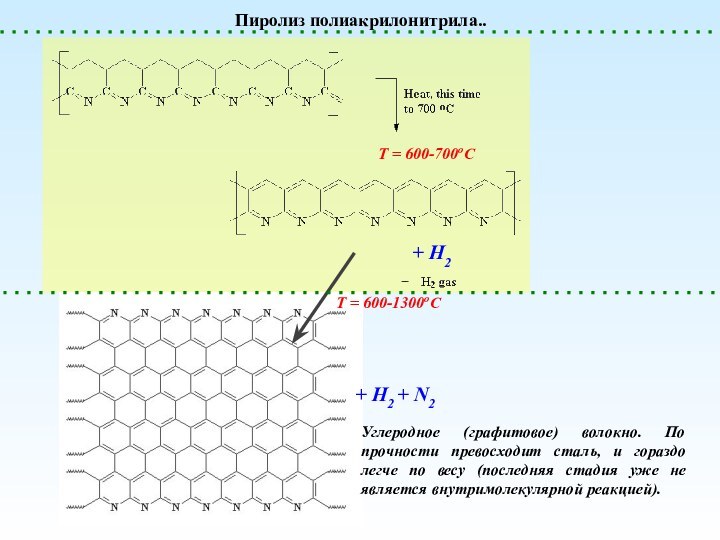
Пиролиз полиакрилонитрила..
Т = 600-700оС
+ H2
Т = 600-1300оС
+
H2 + N2
Углеродное (графитовое) волокно. По прочности превосходит
сталь, и гораздо легче по весу (последняя стадия уже не является внутримолекулярной реакцией).
Слайд 18
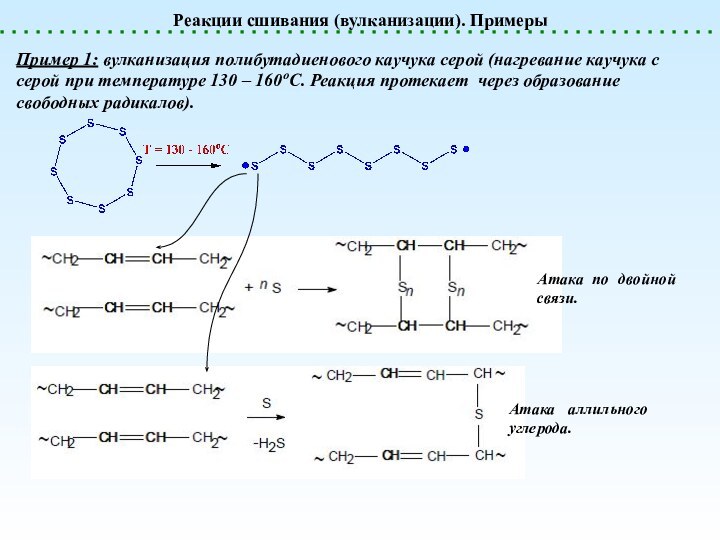
Реакции сшивания (вулканизации). Примеры
Пример 1: вулканизация полибутадиенового каучука
серой (нагревание каучука с серой при температуре 130 –
160оС. Реакция протекает через образование свободных радикалов).Атака по двойной связи.
Атака аллильного углерода.
Слайд 19
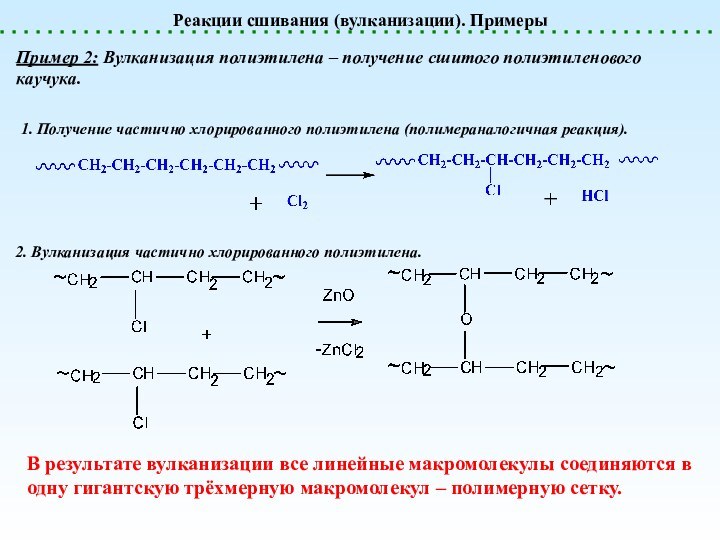
Реакции сшивания (вулканизации). Примеры
Пример 2: Вулканизация полиэтилена –
получение сшитого полиэтиленового каучука.
1. Получение частично хлорированного полиэтилена
(полимераналогичная реакция).2. Вулканизация частично хлорированного полиэтилена.
В результате вулканизации все линейные макромолекулы соединяются в одну гигантскую трёхмерную макромолекул – полимерную сетку.
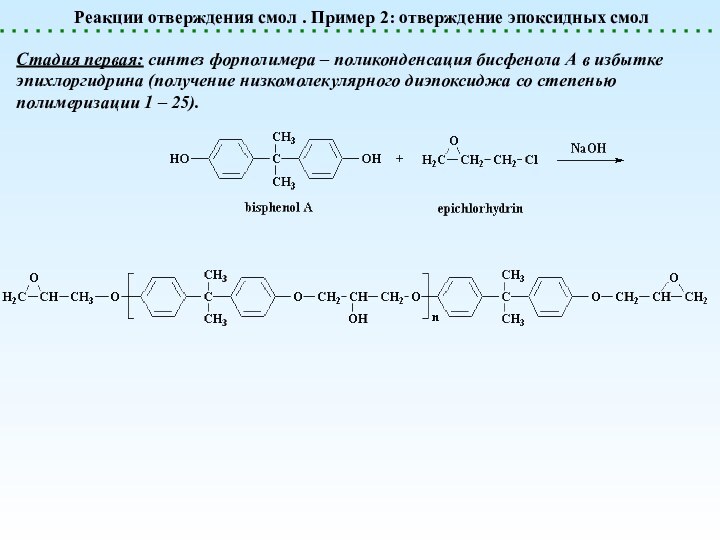
Слайд 21 Реакции отверждения смол . Пример 2: отверждение эпоксидных
смол
Стадия первая: синтез форполимера – поликонденсация бисфенола А
в избытке эпихлоргидрина (получение низкомолекулярного диэпоксиджа со степенью полимеризации 1 – 25).Слайд 22 Реакции отверждения смол . Пример 2: отверждение эпоксидных
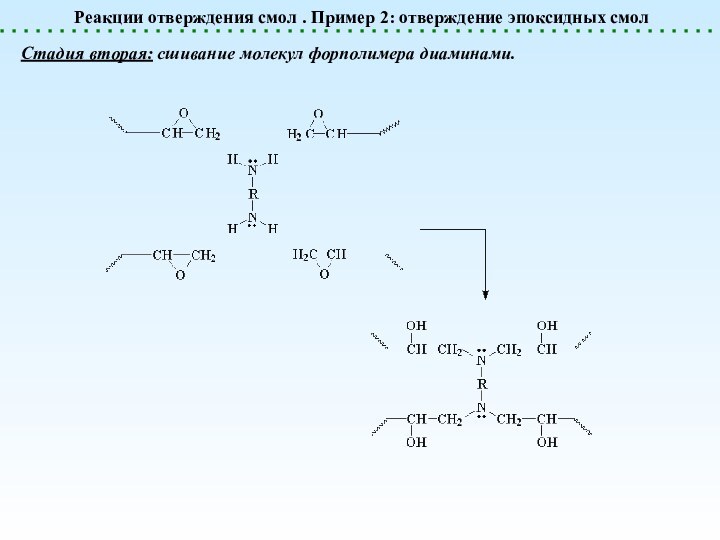
смол
Стадия вторая: сшивание молекул форполимера диаминами.
Слайд 25
Реакции деполимеризации. На примере полиметилметакрилата.
Т 220оС
Механизм реакции
деполимеризации (цепной, свободнорадикальный)
I. Инициирование (образование свободных радикалов):
Такие связи разрываются
в первую очередь с образованием устойчивых аллильных радикаловИЛИ
Слайд 26
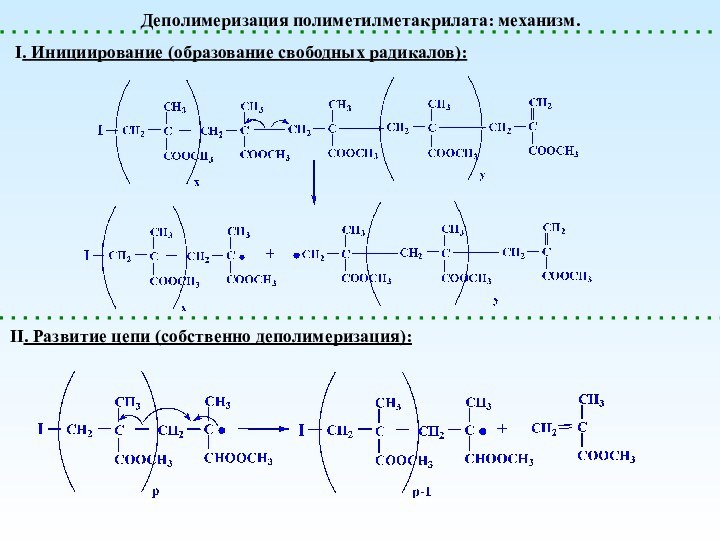
Деполимеризация полиметилметакрилата: механизм.
I. Инициирование (образование свободных радикалов):
II. Развитие
цепи (собственно деполимеризация):
Слайд 27
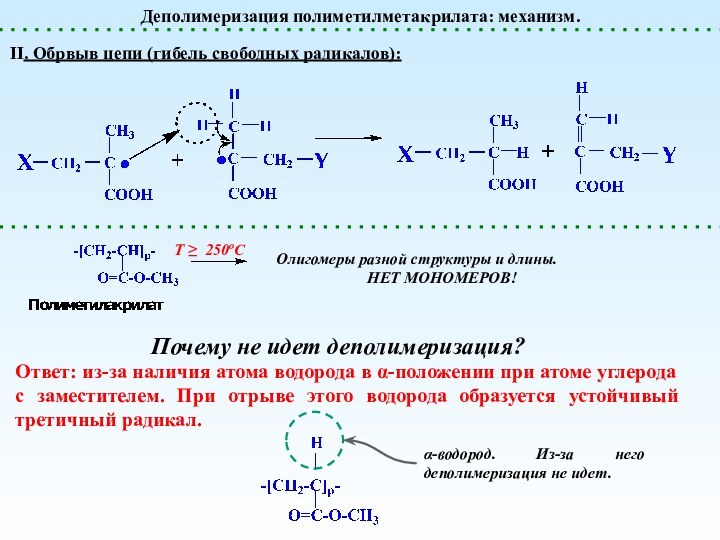
Деполимеризация полиметилметакрилата: механизм.
II. Обрвыв цепи (гибель свободных радикалов):
Т
250оС
Олигомеры разной структуры и длины.
НЕТ МОНОМЕРОВ!
Почему
не идет деполимеризация?Ответ: из-за наличия атома водорода в -положении при атоме углерода с заместителем. При отрыве этого водорода образуется устойчивый третичный радикал.
-водород. Из-за него деполимеризация не идет.
Слайд 28
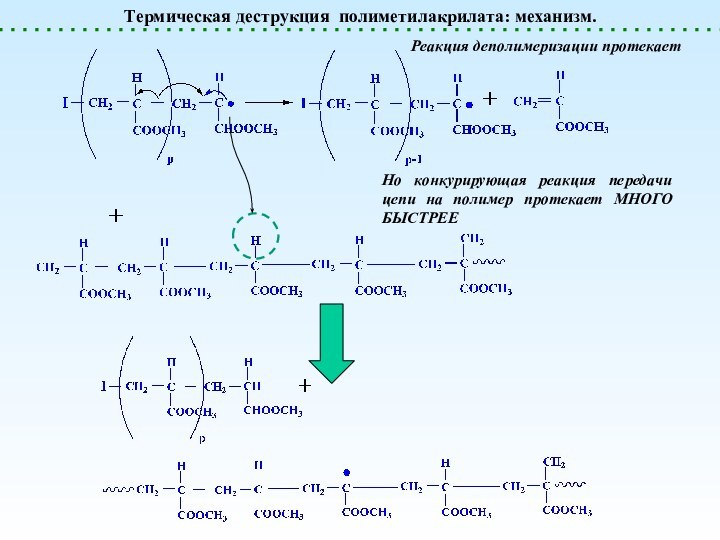
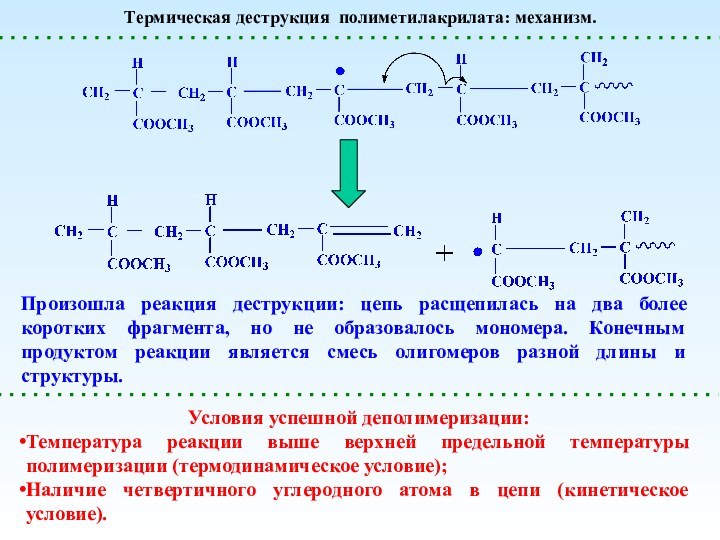
Термическая деструкция полиметилакрилата: механизм.
Реакция деполимеризации протекает
Но конкурирующая реакция
передачи цепи на полимер протекает МНОГО БЫСТРЕЕ
Слайд 29
Термическая деструкция полиметилакрилата: механизм.
Произошла реакция деструкции: цепь расщепилась
на два более коротких фрагмента, но не образовалось мономера.
Конечным продуктом реакции является смесь олигомеров разной длины и структуры.Условия успешной деполимеризации:
Температура реакции выше верхней предельной температуры полимеризации (термодинамическое условие);
Наличие четвертичного углеродного атома в цепи (кинетическое условие).
Слайд 31
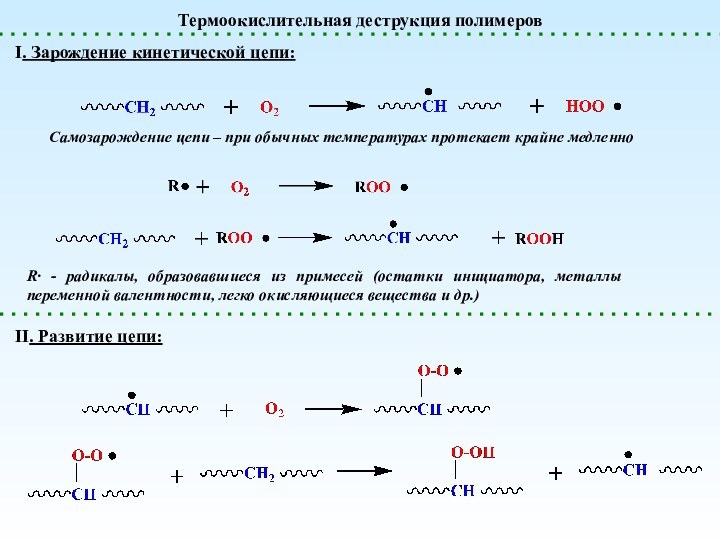
Термоокислительная деструкция полимеров
Самозарождение цепи – при обычных температурах
протекает крайне медленно
I. Зарождение кинетической цепи:
R - радикалы, образовавшиеся
из примесей (остатки инициатора, металлы переменной валентности, легко окисляющиеся вещества и др.)II. Развитие цепи:
Слайд 33
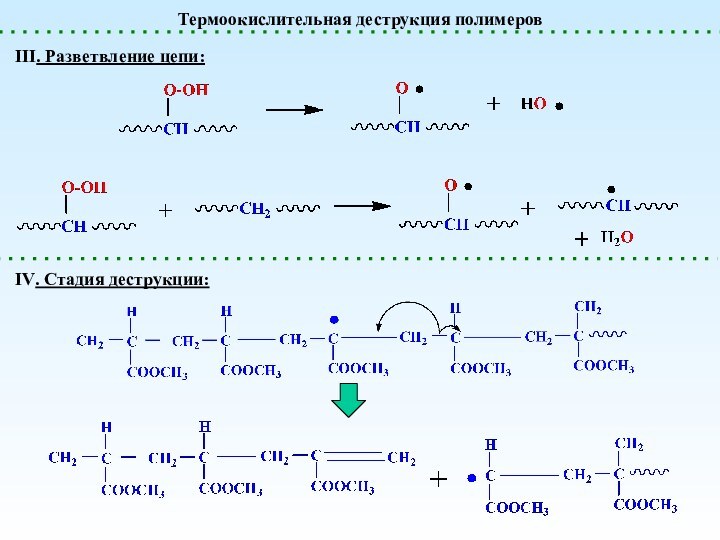
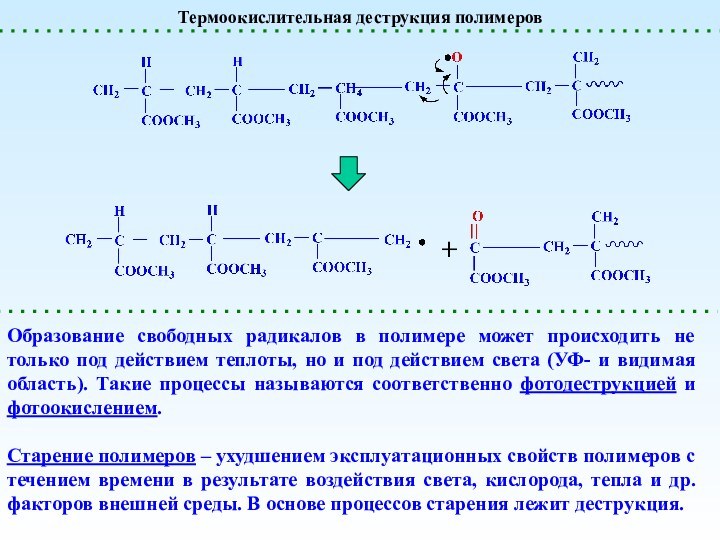
Термоокислительная деструкция полимеров
Образование свободных радикалов в полимере может
происходить не только под действием теплоты, но и под
действием света (УФ- и видимая область). Такие процессы называются соответственно фотодеструкцией и фотоокислением.Старение полимеров – ухудшением эксплуатационных свойств полимеров с течением времени в результате воздействия света, кислорода, тепла и др. факторов внешней среды. В основе процессов старения лежит деструкция.





























