предыдущих уроках?
– Что собой представляет процесс диссоциации?
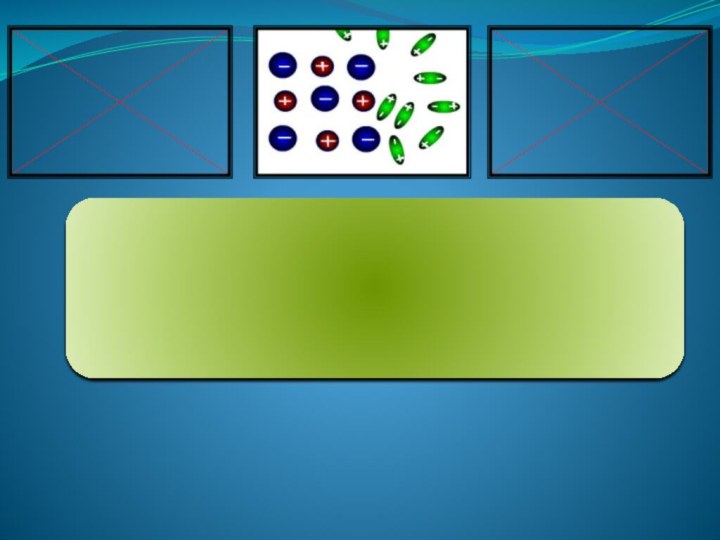
-Что такое электролиты?
-Какие
бывают электролиты?– Что такое ионы?
- Какие бывают ионы?
– Какие ионы присутствуют в растворах солей, оснований, кислот.
-Дайте определение солей, кислот и оснований с точки зрения ТЭД.