- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Ионная химическая связь
Содержание
- 2. Благородные газыБлагородные или инертные газыНазваны так, потому
- 3. Строение атомов благородных газов+22HeNe+1028Ar+18288Kr+3628188Xe+542818832Rn+54281883232Атомы благородных газов имеют
- 4. Что делать атомам других элементов?Na+11281заветная восьмеркаCl+17287 8Химические элементы
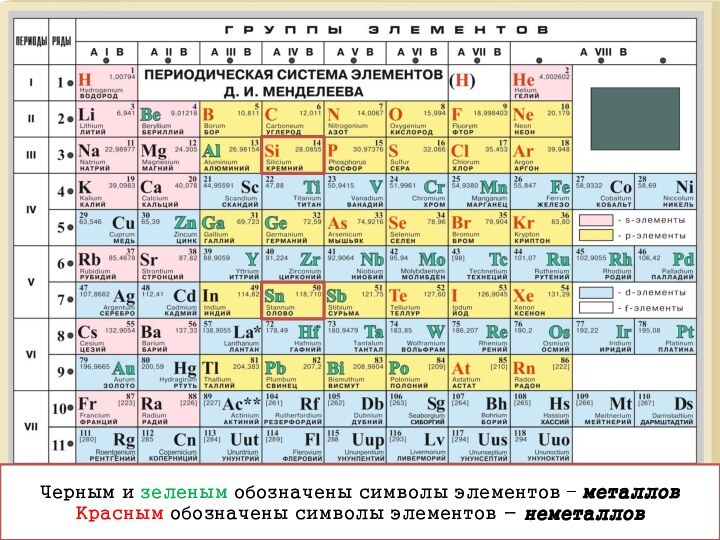
- 5. Черным и зеленым обозначены символы элементов – металловКрасным обозначены символы элементов - неметаллов
- 6. Элементы IV группы, главной подгруппыSn+502818432Si+18284У атома кремния
- 7. Свойство усиливаетсяЗначение увеличиваетсяЗначение неизменноСвойство ослабеваетЗначение уменьшаетсяИзменение свойств
- 8. Изменение свойств атомов химических элементов в периодеСвойство
- 9. Ионная химическая связьNa+11281Cl+17287передача электронаNa+11+28Cl+17288-«+» 11«-» 10Натрий приобретает заряд +1«+» 17«-» 18Хлор приобретает заряд -1Притяжение
- 10. Скачать презентацию
- 11. Похожие презентации
Благородные газыБлагородные или инертные газыНазваны так, потому что эти элементы отличаются малой химической активностью, инертные газы практически не встречаются в составе сложных веществ









Слайд 3
Строение атомов благородных газов
+2
2
He
Ne
+10
2
8
Ar
+18
2
8
8
Kr
+36
2
8
18
8
Xe
+54
2
8
18
8
32
Rn
+54
2
8
18
8
32
32
Атомы благородных газов имеют на
внешнем (последнем) уровне 8 электронов (гелий 2). Это наиболее
устойчивое состояние атома. Этим объясняется химическая инертность этих элементов
Слайд 5
Черным и зеленым обозначены символы элементов – металлов
Красным
обозначены символы элементов - неметаллов
Слайд 6
Элементы IV группы, главной подгруппы
Sn
+50
2
8
18
4
32
Si
+18
2
8
4
У атома кремния 4
внешних электрона находятся на небольшом расстоянии от ядра, сила
притяжения этих электронов к ядру велика, поэтому атом кремния – неметалл (принимает электроны)У атома олова 4 внешних электрона находятся на большом расстоянии от ядра, сила притяжения этих электронов к ядру невелика, поэтому атом кремния –металл (отдает электроны)
Вывод: способность принимать или отдавать электроны зависит не только от того, сколько электронов на внешнем уровне, но и от того, как далеко эти электроны находятся от ядра
Слайд 7
Свойство усиливается
Значение увеличивается
Значение неизменно
Свойство ослабевает
Значение уменьшается
Изменение свойств атомов
химических элементов в подгруппе
Заряд ядер
Число электронов на внешнем уровне
Число
заполняемых энергетических уровнейРадиус атома
Подгруппа начинается неметаллом и заканчивается металлом
Слайд 8
Изменение свойств атомов химических элементов в периоде
Свойство усиливается
Значение
увеличивается
Значение неизменно
Свойство ослабевает
Значение уменьшается
Заряд ядер
Число электронов на внешнем уровне
Число
заполняемых энергетических уровнейРадиус атома
Период начинается металлом и заканчивается неметаллом