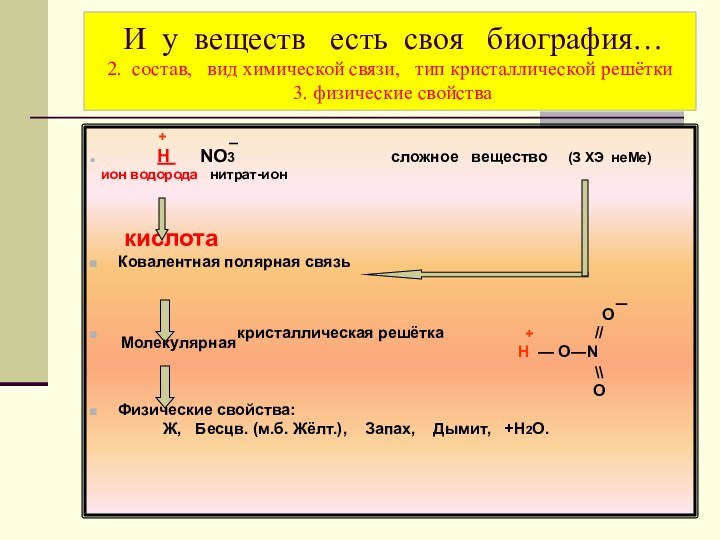
было описано в VIII веке
арабским алхимиком Джабиром ибн Хайяаном (Гебером) в труде «Ямщик мудрости», а с ХV века это вещество добывалось для производственных целей.Она - прародитель большинства взрывчатых веществ (например, тротила, или тола). В 1866 году русский учёный В.Ф. Петрушевский впервые получил динамит.
Это вещество является компонентом ракетного топлива. Её использовали для двигателя первого в мире советского реактивного самолёта БИ – 1.
Она в смеси с соляной кислотой (в соотношении 1v : 3v) растворяет платину и царский металл золото, а сама смесь названа «царской водкой».
Её используют в производстве минеральных удобрений, медицинских препаратов, красителей, пластмасс, фотоматериалов.