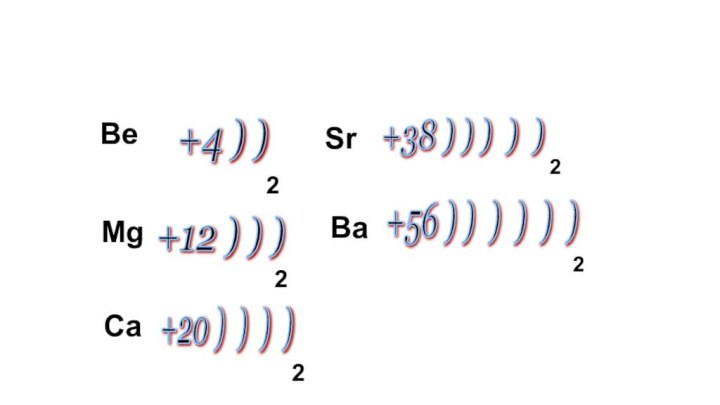
находятся в главной подгруппе II группы.
Являются сильными восстановителями, отдают
2 ē, во всех соединениях проявляют степень окисления +2.
Mg +12 2ē, 8ē, 2ē
Ca +20 2ē, 8ē, 8 ē, 2ē
Sr +38 2ē, 8ē, 18 ē, 8ē, 2ē
Ba +56 2ē, 8ē, 18 ē, 18 ē, 8ē, 2ē