- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему к уроку Гидролиз солей
Содержание
- 2. Условия протекания реакции обмена
- 3. Реакция нейтрализацииNaOH + HCl = NaCl + H2O
- 4. Изменение цвета различных индикаторов при действии растворов кислот и щелочей
- 6. Почему в одном случае индикатор меняет цвет,
- 9. -Какие электролиты называются сильными? слабыми? Привести примеры.Сильная
- 11. Упрощенная схема гидролиза Na2CO3Na2CO3NaOHH2CO3сильное основаниеслабая кислота[OH–]>[H+]Что сильнее, того и больше!Щелочная среда
- 12. Na2CO3 ↔ 2Na+ + СO32–Н2O ↔ Н+
- 13. Соль, образованная сильным основанием и слабой кислотой, имеет щелочную среду, так как в растворе избыток гидроксид-ионов.
- 14. Упрощенная схема гидролиза АlСl3 AlCl3Al(OH)3HCl[OH–][H+]слабое основаниесильная кислотаЧто сильнее, того и больше!Кислая среда>
- 15. АlСl3 ↔ Аl3+ + 3Сl–
- 16. Соль, образованная слабым основанием и сильной кислотой,
- 17. Упрощенная схема гидролиза NaClNaClNaOHHCl[OH–][H+]=сильное основаниесильная кислотаЧто сильнее, того и больше!Нейтральная среда
- 18. NaCl ↔ Na+ + Сl–Н2O ↔ Н+
- 19. Соль, образованная сильным основанием и сильной кислотой,
- 20. Упрощенная схема гидролиза Al2S3 Al2S3Al(OH)3H2S[OH–][H+]слабое основание слабая кислотаЧто сильнее, того и больше!Нейтральная среда=
- 21. Такие соли полностью разлагаются водой до основания
- 22. >
- 23. Химический диктант1.В чистой воде среда нейтральная
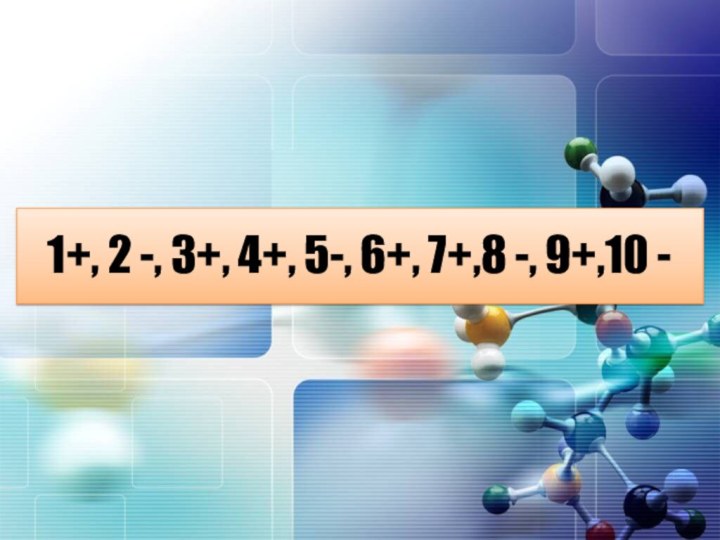
- 24. 1+, 2 -, 3+, 4+, 5-, 6+, 7+,8 -, 9+,10 -
- 25. Самостоятельная работа 1 вариант
- 28. 1.Задача: Определить количество ионов
- 29. 1.Тема нашего сегодняшнего урока …2. Передо мной
- 30. Скачать презентацию
- 31. Похожие презентации
Условия протекания реакции обмена










![Презентация к уроку Гидролиз солей Упрощенная схема гидролиза Na2CO3Na2CO3NaOHH2CO3сильное основаниеслабая кислота[OH–]>[H+]Что сильнее, того и больше!Щелочная среда](/img/tmb/7/608976/b8079c02edde25385c7434876aee8e97-720x.jpg)

![Презентация к уроку Гидролиз солей Упрощенная схема гидролиза АlСl3 AlCl3Al(OH)3HCl[OH–][H+]слабое основаниесильная кислотаЧто сильнее, того и больше!Кислая среда>](/img/tmb/7/608976/68812522d0b6c20d759bc9ce39e2161c-720x.jpg)


![Презентация к уроку Гидролиз солей Упрощенная схема гидролиза NaClNaClNaOHHCl[OH–][H+]=сильное основаниесильная кислотаЧто сильнее, того и больше!Нейтральная среда](/img/tmb/7/608976/d3dac21e67d9016cba736151ff4cbde7-720x.jpg)

![Презентация к уроку Гидролиз солей Упрощенная схема гидролиза Al2S3 Al2S3Al(OH)3H2S[OH–][H+]слабое основание слабая кислотаЧто сильнее, того и больше!Нейтральная среда=](/img/tmb/7/608976/8a51a38184857536cdff7df77594c687-720x.jpg)






Слайд 6 Почему в одном случае индикатор меняет цвет, а
в другом нет? Какой вывод мы можем сделать на
основе этих наблюдений? Что кроме соли ещё присутствует в растворе? «ГИДРОЛИЗ» - от греческого «гидро» - вода «лизис» - разложение
Слайд 9
-Какие электролиты называются сильными? слабыми? Привести примеры.
Сильная кислота
- это ... .
Привести примеры (5-6) сильных кислот
- Сильное основание - это ... . Привести примеры (4-5) .
- Слабая кислота - это ... . Привести примеры
- Слабое основание - это ...
Слайд 11
Упрощенная схема гидролиза Na2CO3
Na2CO3
NaOH
H2CO3
сильное основание
слабая кислота
[OH–]
>
[H+]
Что сильнее, того
и больше!
Щелочная среда
Слайд 12
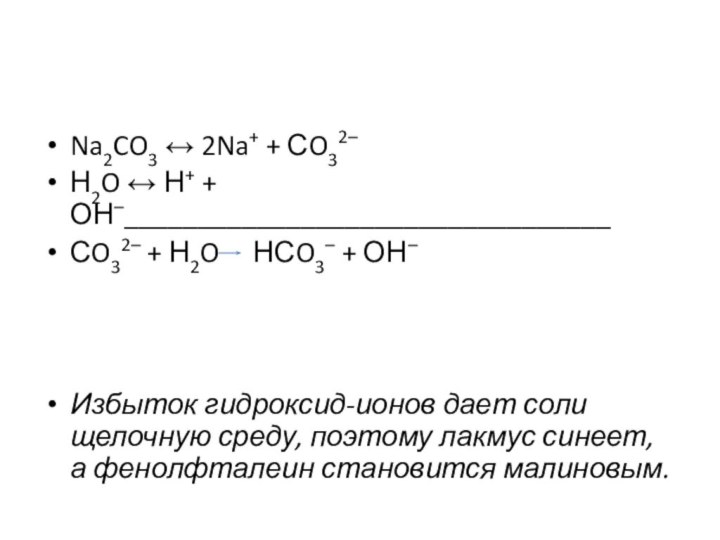
Na2CO3 ↔ 2Na+ + СO32–
Н2O ↔ Н+ +
ОН–_________________________________
СO32– + Н2O НСO3– + ОН–
Избыток гидроксид-ионов
дает соли щелочную среду, поэтому лакмус синеет, а фенолфталеин становится малиновым.Слайд 13 Соль, образованная сильным основанием и слабой кислотой, имеет
щелочную среду, так как в растворе избыток гидроксид-ионов.
Слайд 14
Упрощенная схема гидролиза АlСl3
AlCl3
Al(OH)3
HCl
[OH–]
[H+]
слабое основание
сильная
кислота
Что сильнее, того и больше!
Кислая среда
>
Слайд 15 АlСl3 ↔ Аl3+ + 3Сl–
Н2O ↔ Н+ + ОН–
________________________
Аl3+ + Н2O АlOН2+ + Н+
Избыток ионов водорода дает соли кислую среду, поэтому лакмус краснеет.
Слайд 16 Соль, образованная слабым основанием и сильной кислотой, имеет
кислую среду, так как в растворе избыток ионов водорода.
Слайд 17
Упрощенная схема гидролиза NaCl
NaCl
NaOH
HCl
[OH–]
[H+]
=
сильное основание
сильная кислота
Что сильнее, того
и больше!
Нейтральная среда
Слайд 18
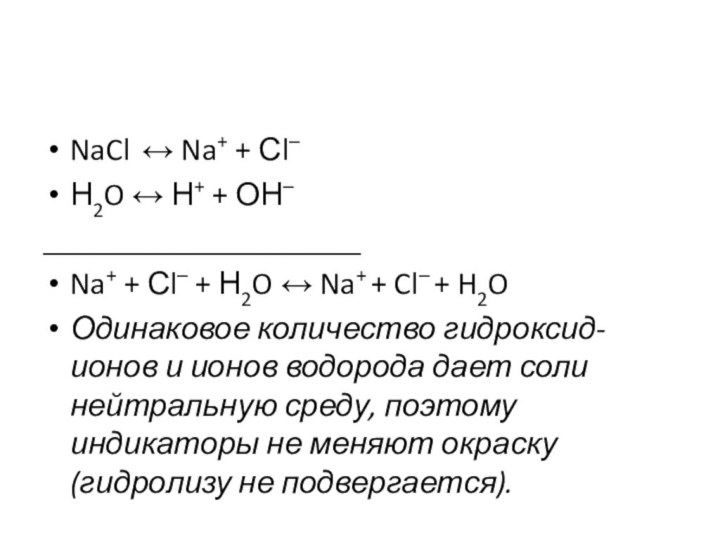
NaCl ↔ Na+ + Сl–
Н2O ↔ Н+ +
ОН–
____________________
Na+ + Сl– + Н2O ↔ Na+ + Cl–
+ H2OОдинаковое количество гидроксид-ионов и ионов водорода дает соли нейтральную среду, поэтому индикаторы не меняют окраску (гидролизу не подвергается).
Слайд 19 Соль, образованная сильным основанием и сильной кислотой, имеет
нейтральную среду, так как в растворе одинаковое количество ионов
водорода и гидроксид-ионов.
Слайд 20
Упрощенная схема гидролиза Al2S3
Al2S3
Al(OH)3
H2S
[OH–]
[H+]
слабое основание
слабая кислота
Что сильнее, того и больше!
Нейтральная среда
=
Слайд 21 Такие соли полностью разлагаются водой до основания и
кислоты
Al2S3+6H2O 2Al(OH)3 +3H2S
В растворе сохраняется
нейтральная
среда
Слайд 23
Химический диктант
1.В чистой воде среда нейтральная
2.Раствор
соляной кислоты – слабый электролит.
3.Соль Na2CO3 образована сильным основанием
и слабой кислотой.4.Соль AlCl3 образована слабым основанием и сильной кислотой.
5.Водный раствор соли NaCl имеет кислую среду
6.Водный раствор соли K2SO4 имеет нейтральную среду
7.Водный раствор соли Al2(SO4)3 имеет кислую среду
8.Соль KNO3 подвергается необратимому гидролизу с выпадением осадка.
9.Раствор соли Na2SiO3 при действии фенолфталеина окрасится в малиновый цвет.
10.Раствор соли K2CO3 при действии фенолфталеина остается бесцветным
Слайд 25
Самостоятельная работа
1 вариант
2 вариант
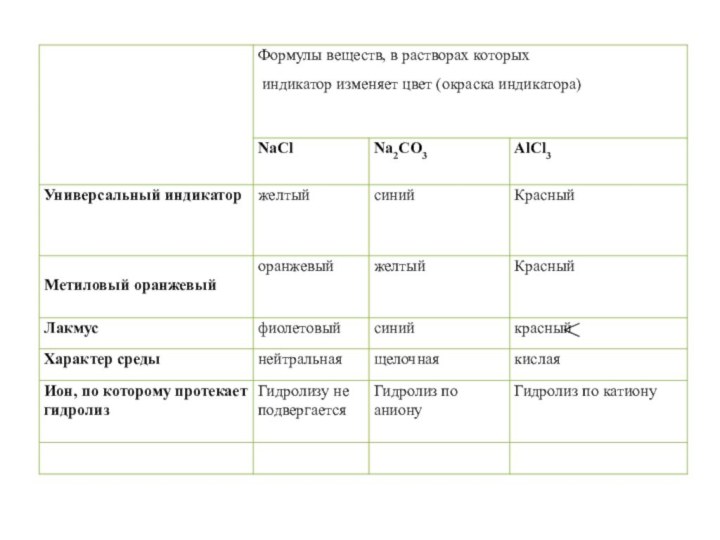
хлорид меди (II) сульфит натрия
Составьте ионное уравнение гидролиза этих солей.
Слайд 26
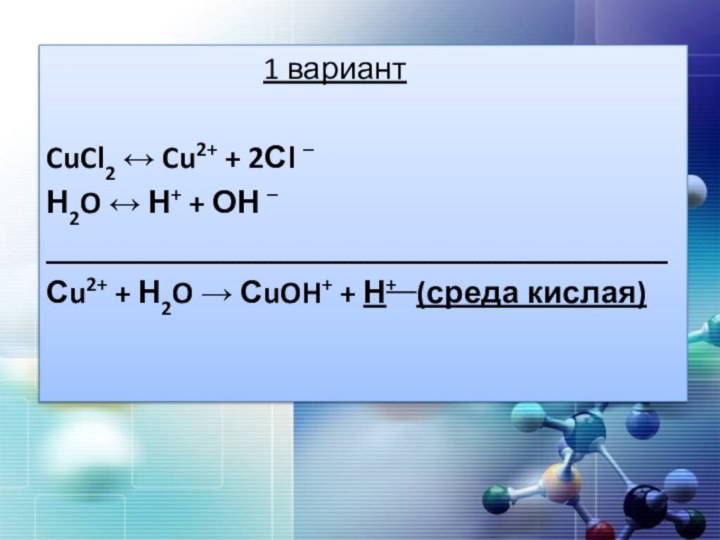
1 вариант
CuCl2
↔ Cu2+ + 2Сl –Н2O ↔ Н+ + ОН –
_______________________________________
Сu2+ + Н2O → СuOH+ + Н+ (среда кислая)
Слайд 27
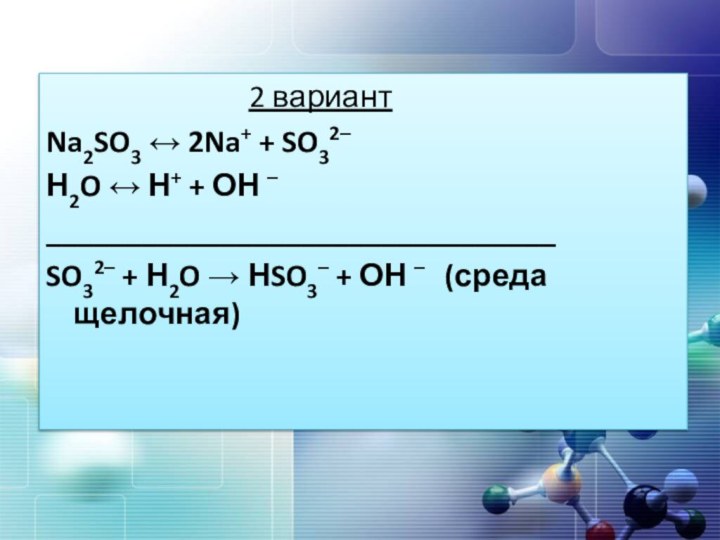
2 вариант
Na2SO3 ↔
2Na+ + SO32–Н2O ↔ Н+ + ОН –
________________________________
SO32– + Н2O → НSO3– + ОН – (среда щелочная)
Слайд 28 1.Задача: Определить количество ионов водорода
в серной кислоте, массой 198г.
2.Задача: Определить
количество гидроксид - ионов в гидроксиде бария, массой 342 г. Задачи
Слайд 29
1.Тема нашего сегодняшнего урока …
2. Передо мной на
уроке стояла цель …
3. Сегодня я узнал …
4. Было
интересно …5. Было сложно…
6.Я понял, что …
7. Теперь я могу …
8. Я научился …
9. Я работал на уроке…
10.Выводы урока таковы …
Продолжи предложение





























