- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основные классы неорганических соединений
Содержание
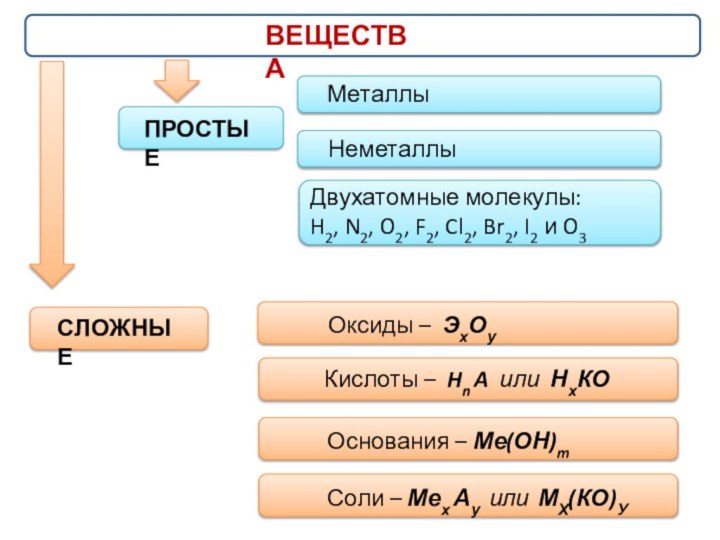
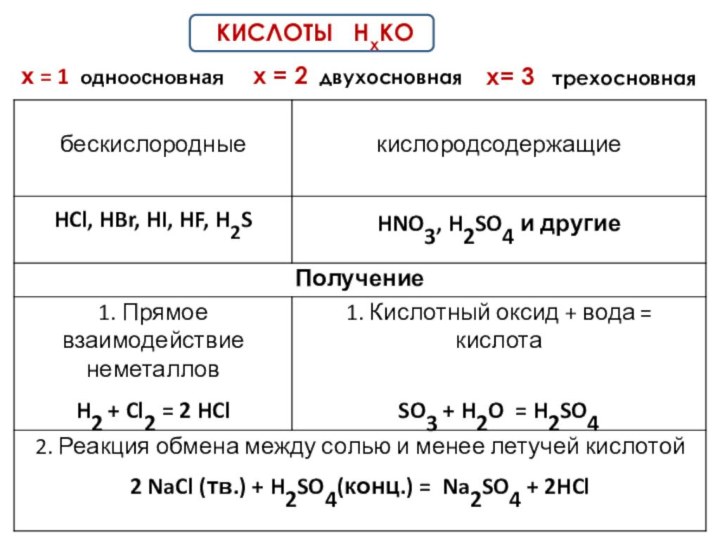
- 2. ВЕЩЕСТВАПРОСТЫЕМеталлыДвухатомные молекулы: H2, N2, O2, F2, Cl2, Br2, I2 и O3НеметаллыСЛОЖНЫЕОксиды – ЭхОу Кислоты – Hn A или НхКООснования – Ме(ОН)mСоли – Мех Ау или МХ(КО)У
- 3. х = 1 одноосновная КИСЛОТЫ НхКОх = 2 двухосновнаях= 3 трехосновная
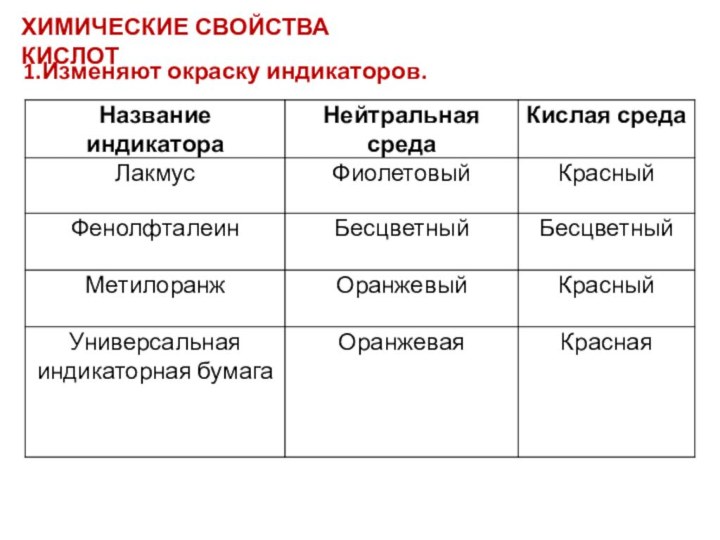
- 4. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ1.Изменяют окраску индикаторов.
- 5. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ2.Реагируют с металлами в ряду
- 6. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ4. Реагируют с основаниями – реакция нейтрализацииКИСЛОТА
- 7. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ6. Разложение кислородсодержащих кислот при нагревании ( искл. H2SO4 ; H3PO4 )КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р.разложения)
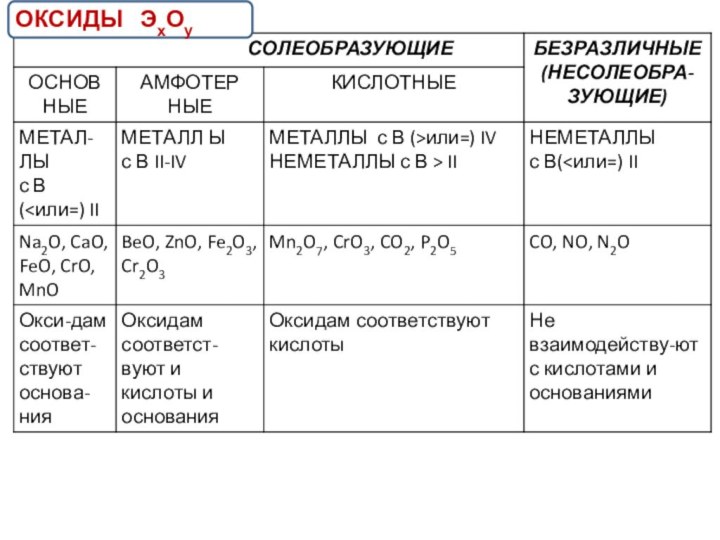
- 8. ОКСИДЫ ЭхОу
- 9. Основной оксид + Кислотный оксид = Соль
- 10. Кислотный оксид + Вода = Кислота (р. соединения)СO2 + H2O = H2CO3, SiO2 –
- 11. Взаимодействуют как с кислотами, так и со
- 12. х=1 однокислотное х=2 двухкислотное х=3 трехкислотноеОСНОВАНИЯ Me(OH)m
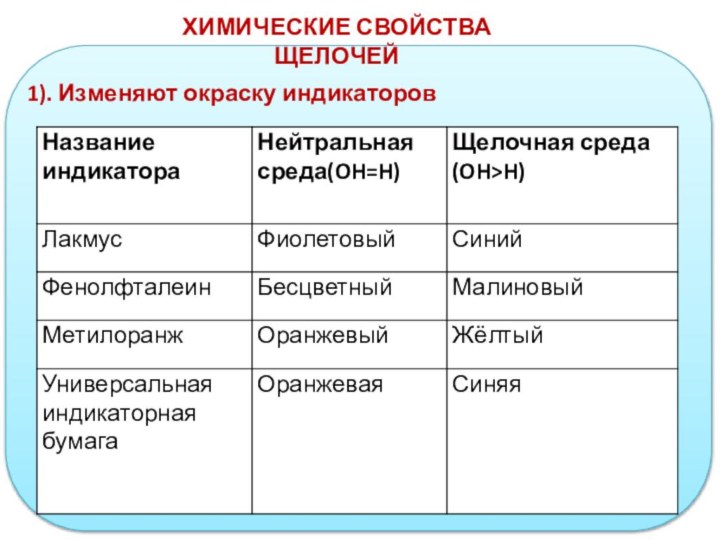
- 13. ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧЕЙ1). Изменяют окраску индикаторов
- 14. 3) Взаимодействие с кислотамиЩёлочь +
- 15. ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧЕЙ4) С растворами солей,
- 16. ХИМИЧЕСКИЕ СВОЙСТВА НЕРАСТВОРИМЫХ ОСНОВАНИЙ1) С кислотами -реакция
- 17. 1.Реагируют с кислотами: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O2.Реагируют со щелочами: Zn(OH)2 + 2NaOH = Na2 [Zn(OH)4]АМФОТЕРНЫЕ ГИДРОКСИДЫ (нерастворимы в воде)
- 18. СОЛИ МХ(КО)УСРЕДНИЕ Na2SO4КИСЛЫЕ NaHSO4ДВОЙНЫЕK2NaPO4СМЕШАННЫЕCa-OCl│ClКОМПЛЕКСНЫЕ Na[Al(OH)4]ОСНОВНЫЕ Mg(OH)Cl
- 19. Из металлов: металл + неметалл = соль
- 20. 2. Из оксидов: кислотный оксид + щелочь
- 21. 3. Реакция нейтрализации: кислота + основание = соль + вода HCl + NaOH = NaCl + H2O ПОЛУЧЕНИЕ
- 22. 4. Из солей: соль1 + соль2 = соль3 + соль4↓ NaCl + AgNO3 = NaNO3 + AgCl¯соль
- 23. Скачать презентацию
- 24. Похожие презентации






![Презентация Основные классы неорганических соединений Взаимодействуют как с кислотами, так и со щелочами.ZnO + 2 HCl = ZnCl2 + H2OZnO + 2 NaOH + H2O = Na2[Zn(OH)4] ( в растворе)ZnO +](/img/tmb/6/517928/5e9230c4f6d281fcc3861cab63911f4a-720x.jpg)




![Презентация Основные классы неорганических соединений 1.Реагируют с кислотами: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O2.Реагируют со щелочами: Zn(OH)2 + 2NaOH = Na2 [Zn(OH)4]АМФОТЕРНЫЕ ГИДРОКСИДЫ (нерастворимы в воде)](/img/tmb/6/517928/f6d0bd6dda431b51701059baf4467286-720x.jpg)
![Презентация Основные классы неорганических соединений СОЛИ МХ(КО)УСРЕДНИЕ Na2SO4КИСЛЫЕ NaHSO4ДВОЙНЫЕK2NaPO4СМЕШАННЫЕCa-OCl│ClКОМПЛЕКСНЫЕ Na[Al(OH)4]ОСНОВНЫЕ Mg(OH)Cl](/img/tmb/6/517928/b13d3aef8bd80def71845e4fe46d9849-720x.jpg)





Слайд 2
ВЕЩЕСТВА
ПРОСТЫЕ
Металлы
Двухатомные молекулы:
H2, N2, O2, F2, Cl2, Br2, I2 и O3
Неметаллы
СЛОЖНЫЕ
Оксиды – ЭхОу
Кислоты – Hn A или НхКО
Основания – Ме(ОН)m
Соли – Мех Ау или МХ(КО)У
Слайд 5
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
2.Реагируют с металлами в ряду активности
до H2
(искл. HNO3 –азотная кислота)
Ме + КИСЛОТА = СОЛЬ + H2↑ (р. замещения)
Zn +
2 HCl = ZnCl2 + H2 3. С основными (амфотерными) оксидами – оксидами металлов
МехОу+ КИСЛОТА= СОЛЬ + Н2О (р. обмена)
CuO + H2SO4 = Cu SO4 + H2O
Слайд 6
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА +
ОСНОВАНИЕ= СОЛЬ+ H2O ( р. обмена)
5. Реагируют с солями слабых, летучих
кислот - если образуется соль, выпадающая в осадок или выделяется газ:
2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl ( р. обмена)
Сила кислот убывает в ряду:
HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2>H2CO3 > H2S > H2SiO3 .
Каждая предыдущая кислота может вытеснить из соли последующую
Слайд 7
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
6. Разложение кислородсодержащих кислот при нагревании
(
искл. H2SO4 ; H3PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА
(р.разложения)
Слайд 9
Основной оксид + Кислотный оксид = Соль
(р.
соединения)
CaO + SO2 = CaSO3
2. Основной оксид + Кислота = Соль + Н2О
(р. обмена)
3K2O + 2H3PO4 = 2K3PO4 + 3H2O
3. Основной оксид + Вода = Щёлочь
(р. соединения)
Na2O + H2O = 2NaOH
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
Слайд 10
Кислотный оксид + Вода = Кислота
(р. соединения)
СO2 + H2O = H2CO3, SiO2 – не
реагирует
2. Кислотный оксид + Основание = Соль + Н2О
(р.
обмена)P2O5 + 6KOH = 2K3PO4 + 3H2O
3. Основной оксид + Кислотный оксид = Соль
(р. соединения)
CaO + SO2 = CaSO3
4. Менее летучие вытесняют более летучие из их солей
CaCO3 + SiO2 = CaSiO3 +CO2
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
Слайд 11
Взаимодействуют как с кислотами,
так и со щелочами.
ZnO +
2 HCl = ZnCl2 + H2O
ZnO + 2 NaOH + H2O = Na2[Zn(OH)4] ( в растворе)
ZnO + 2 NaOH = Na2ZnO2 + H2O (при сплавлении)
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
Слайд 14
3) Взаимодействие с кислотами
Щёлочь +
Кислота = Соль + Вода
-реакция обмена (нейтрализация)
Ca(OH)2 + 2HNO3 = Ca(NO3)2 +
2H2OХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧЕЙ
2) Взаимодействие с кислотными оксидами
Щёлочь + Кислотный оксид = Соль + Вода
- реакция обмена
2KOH + CO2 = K2CO3 + H2O
Слайд 15
ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧЕЙ
4) С растворами солей,
если в результате
образуется осадок
Соль + Щёлочь =
Нерастворимое
основание ↓ + Новая соль(раствор)
-реакция обмена
FeCI3 + 3NaOH = Fe(OH)3↓ + 3NaCl
Слайд 16
ХИМИЧЕСКИЕ СВОЙСТВА НЕРАСТВОРИМЫХ ОСНОВАНИЙ
1) С кислотами -реакция
обмена
М(OH)n↓ + Кислота = Соль + вода
2) Разлагаются при
нагревании n t n II
М(OH)n ↓ = Mx Oy + H2O
-реакция разложения
Cu(OH)2 = CuO + H2O или 2Fe(OH)3 = Fe2O3 +3H2O
Слайд 17
1.Реагируют с кислотами:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2.Реагируют со щелочами:
Zn(OH)2 +
2NaOH = Na2 [Zn(OH)4]
АМФОТЕРНЫЕ ГИДРОКСИДЫ
(нерастворимы в воде)
Слайд 18
СОЛИ МХ(КО)У
СРЕДНИЕ
Na2SO4
КИСЛЫЕ
NaHSO4
ДВОЙНЫЕ
K2NaPO4
СМЕШАННЫЕCa-OCl
│
Cl
КОМПЛЕКСНЫЕ Na[Al(OH)4]
ОСНОВНЫЕ
Mg(OH)Cl
Слайд 19
Из металлов:
металл + неметалл = соль
Fe + S = FeS
металл
(металлы до Н2) + кислота (р-р) = соль +
Н2Zn +2 HCl = ZnCl2 + H2
Металл1 + соль = металл2 + соль*
(металл2 стоит в ряду активности правее)
Fe + CuCl2 = FeCl2 + Cu
ПОЛУЧЕНИЕ
Слайд 20
2. Из оксидов:
кислотный оксид + щелочь =
соль + вода
SO3 + 2 NaOH = Na2SO4 + H2O
основный оксид + кислота = соль
+ вода CuO + H2SO4 = CuSO4 + H2O
основный оксид + кислотный оксид = соль
Na2O + CO2 = Na2CO3
ПОЛУЧЕНИЕ
Слайд 21
3. Реакция нейтрализации:
кислота + основание = соль
+ вода
HCl + NaOH = NaCl + H2O
ПОЛУЧЕНИЕ
Слайд 22
4. Из солей:
соль1 + соль2 = соль3 + соль4↓
NaCl + AgNO3 = NaNO3 + AgCl¯
соль +
щелочь = основание↓ + соль*
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
соль + кислота = кислота*
+ соль*2NaCl + H2SO4 = 2HCl + Na2SO4
Примечание: Все реакции обмена протекают до конца, если одно из образующихся веществ нерастворимо в воде(осадок), газ или вода.
ПОЛУЧЕНИЕ