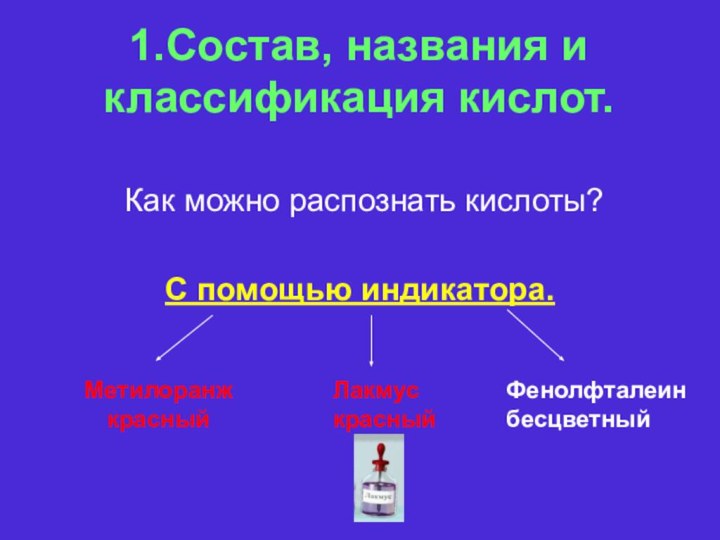
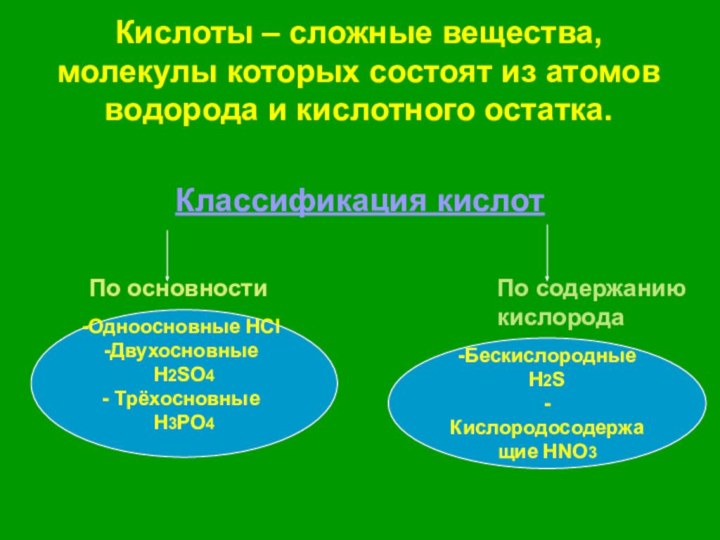
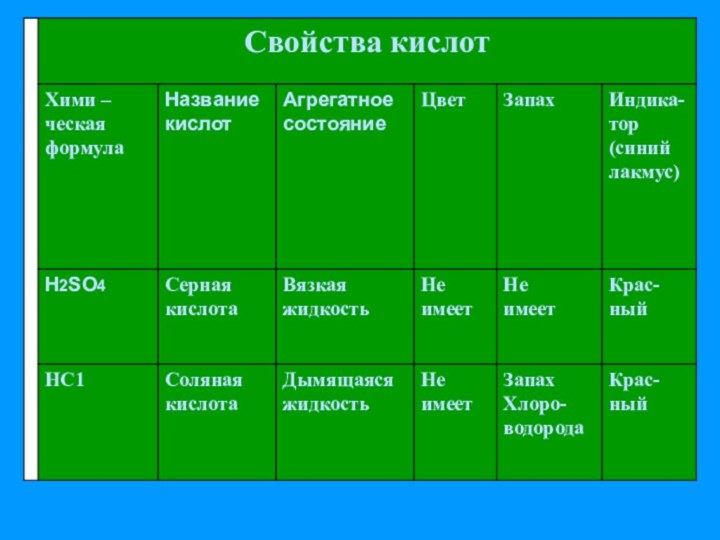
названиями, классификацией и представителями класса кислот.
2. Продолжить
знакомство со сложными ионами на примере ионов кислотных остатков кислородных кислот.3. Продолжить формирование знаний о различиях между зарядами ионов и степенью окисления элементов, об индикаторах.