- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Строение атома 11 класс
Содержание
- 2. Ранние модели строения атома«Пудинг с изюмом» (1902-1904
- 3. Современная модель атомаАтом – электронейтральная частицаЯдро атома
- 4. Состав ядра атомаПротоны. Масса = 1,
- 5. ИзотопыИзотопы – совокупность атомов, имеющих одинаковое число
- 6. Важные понятияЭлектронное облако – пространство около ядра
- 7. Квантовые числаl – побочное квантовое число; уточняет
- 9. Квантовые числаms – магнитное спиновое квантовое число
- 10. Принципы заполнения электронных оболочекПринцип минимальной энергии:принцип Паулиправило Хундаправило Клечковского
- 11. Правило КлечковскогоЗаполнение электронами орбиталей в атоме происходит
- 12. Электронные семействаs-элементы, если заполняется
- 13. Электронная формула
- 14. «Провал» электронаВ атомах некоторых элементов электрон с
- 15. Скачать презентацию
- 16. Похожие презентации
Ранние модели строения атома«Пудинг с изюмом» (1902-1904 г. Дж. Томсон)«Планетарная» (1907 г. Э. Резерфорд)«Модель Бора» (1913 г.)














Слайд 3
Современная модель атома
Атом – электронейтральная частица
Ядро атома –
положительно заряженное
Электроны – отрицательно заряженные
Электроны вращаются вокруг ядра с
определённой скоростьюЭлектроны имеют двойственную природу
Слайд 4
Состав ядра атома
Протоны.
Масса = 1, заряд =
+1
Нейтроны.
Масса = 1, заряд = 0
Заряд ядра определяется количеством
протоновКоличество протонов соответствует порядковому номеру элемента в ПСХЭ
Слайд 5
Изотопы
Изотопы – совокупность атомов, имеющих одинаковое число протонов,
но различающихся количеством нейтронов в ядре атома.
Изотопы различны атомной
массой (А)Число нейтронов определяется по формуле: N = A – Z, где Z – порядковый номер элемента
Слайд 6
Важные понятия
Электронное облако – пространство около ядра атома,
где сосредоточены вся масса электрона и электронная плотность
Атомная орбиталь
– часть э.о., где сосредоточено >90% электронной плотностиРадиус АО – расстояние от ядра атома до максимальной электронной плотности
Слайд 7
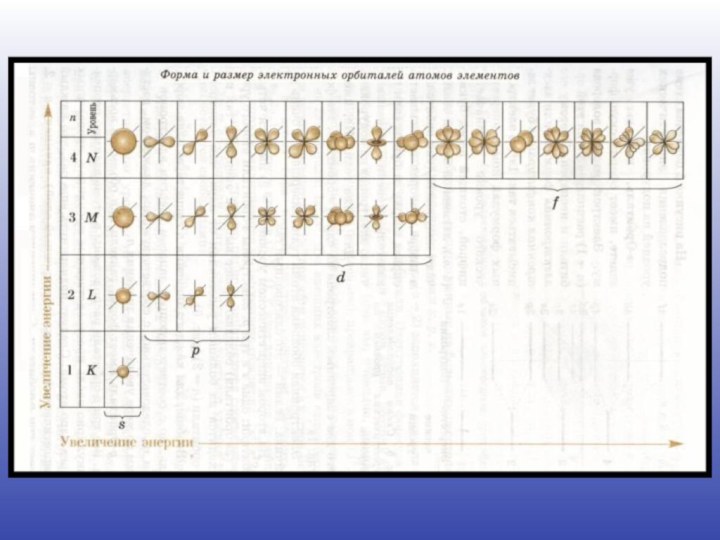
Квантовые числа
l – побочное квантовое число; уточняет запас
энергии электрона на энергетическом уровне, хар-т связь e с
ядром, а так же форму АО. Значения от 0 до n-1l=0 – подуровень s, форма орбитали сферическая
l=1 – подуровень p, объёмная форма орбитали
l=2 – подуровень d, более сложная форма орбитали
l=3 – подуровень f, более сложная форма орбитали
Номер э.у. соответствует к-ву подуровней на данном энергетическом уровне
Слайд 9
Квантовые числа
ms – магнитное спиновое квантовое число характеризует
чисто квантовое свойство электрона
Это собственный момент импульса электрона
Абсолютное значение
спина = ½Проекция спина на ось может иметь лишь два значения: ms=+1/2; ms=-1/2