- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Типы химических реакций
Содержание
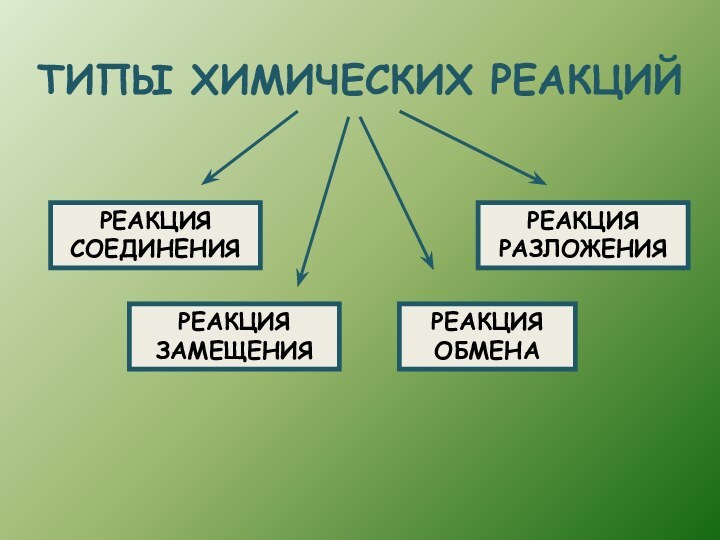
- 2. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙРЕАКЦИЯ СОЕДИНЕНИЯРЕАКЦИЯ РАЗЛОЖЕНИЯРЕАКЦИЯ ЗАМЕЩЕНИЯРЕАКЦИЯ ОБМЕНА
- 3. П.П. Бажов«Малахитовая шкатулка»
- 4. Реакция разложения малахита:
- 5. – это реакции, в результате которых сложное
- 6. Подавляющее большинство реакций разложения эндотермичны и требуют
- 7. 1) CaO + CO2 = CaCO32) CO2
- 8. – это реакции, в которых из нескольких
- 9. Fe + S - FeS Zn +
- 10. 1) 2HgO = 2Hg + O22) CaCO3
- 11. Реакции между простым и сложным веществом, в
- 12. Zn + HCl – ZnCl2 + H2Fe
- 13. Реакции между двумя сложными веществами, в результате
- 14. CuO + HCl – CuCl2 + H2OMgO
- 16. Домашнее задание:Оформить на альбомном листе работу, где
- 20. Скачать презентацию
- 21. Похожие презентации
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙРЕАКЦИЯ СОЕДИНЕНИЯРЕАКЦИЯ РАЗЛОЖЕНИЯРЕАКЦИЯ ЗАМЕЩЕНИЯРЕАКЦИЯ ОБМЕНА







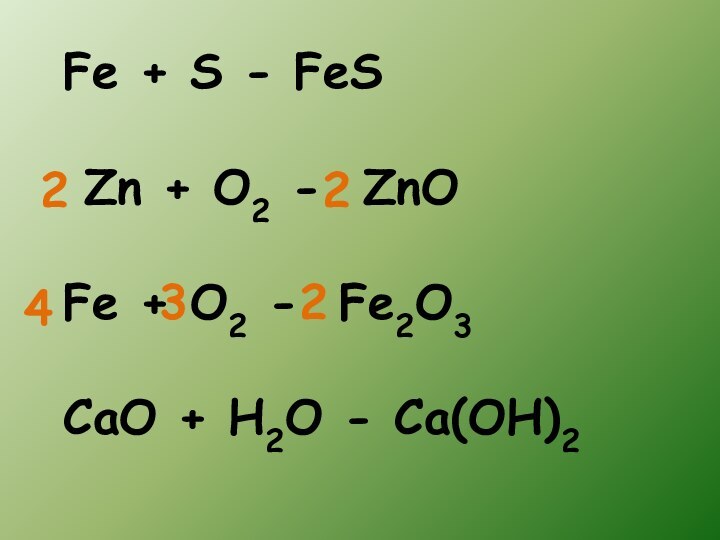



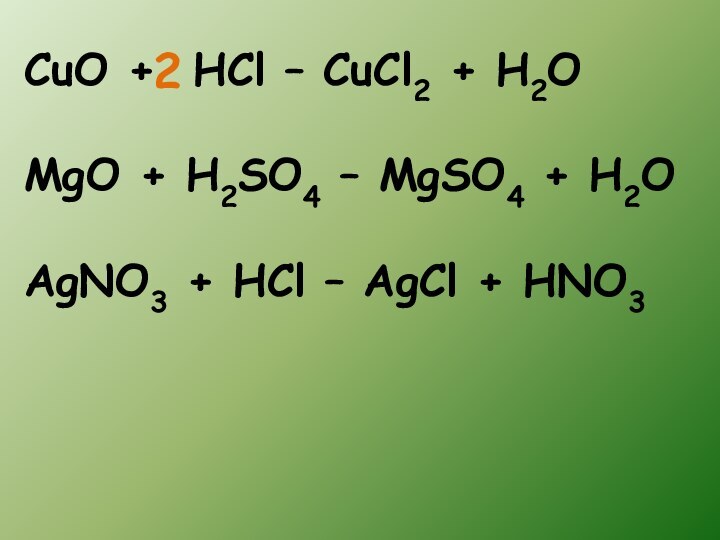






Слайд 5 – это реакции, в результате которых сложное вещество
разлагается на несколько других, более простых веществ.
Слайд 6 Подавляющее большинство реакций разложения эндотермичны и требуют для
своего проведения повышенной температуры. Например:
HgO – Hg + O2
CaCO3
– CaO + CO2Cu(OH)2 – CuO + H2O
Al(OH)3 – Al2O3 + H2O
2
2
3
2
Слайд 7
1) CaO + CO2 = CaCO3
2) CO2 +
2NaOH = Na2CO3 + H2O
3) Fe + S =
FeS4) 2H2O = 2H2 + O2↑
5) CuO + H2 = Cu + H2O
6) Zn + 2HCl = ZnCl2 + H2↑
7) ZnO + H2SO4 = ZnSO4 + H2O
8) Cu(OH)2 = CuO + H2O
Слайд 8 – это реакции, в которых из нескольких простых
или сложных веществ образуется одно более сложное вещество.
Реакции
соединения - Подавляющее большинство реакций соединения экзотермичны.
Слайд 10
1) 2HgO = 2Hg + O2
2) CaCO3 =
CaO + CO2
3) CuSO4 + Fe = Cu +
FeSO44) CuO + H2 = Cu + H2O
5) 2H2 + O2 = 2H2O
6) H2SO4 + 2KOH = K2SO4 + 2H2O
7) BaO + SO2 = BaSO3
Слайд 11 Реакции между простым и сложным веществом, в результате
которых атомы простого вещества замещают атомы одного из элементов
сложного вещества, называются реакциями замещения.Реакции замещения -
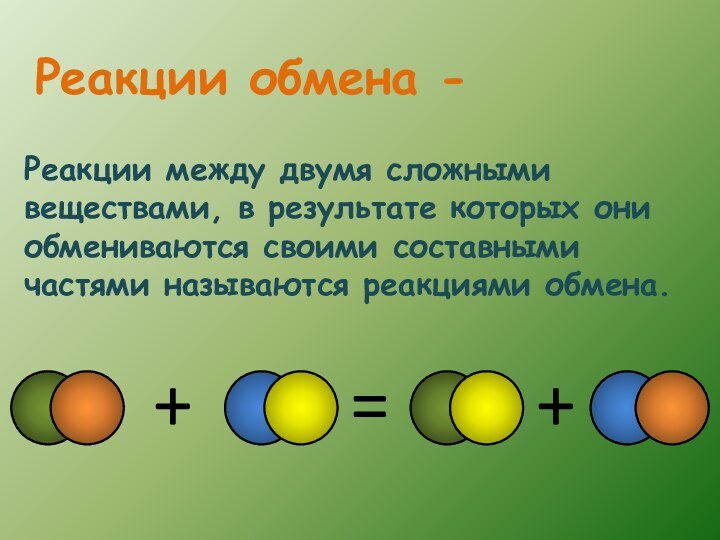
Слайд 13 Реакции между двумя сложными веществами, в результате которых
они обмениваются своими составными частями называются реакциями обмена.
Реакции обмена
-
Слайд 16
Домашнее задание:
Оформить на альбомном листе работу, где необходимо
привести примеры разных типов реакций и нарисовать рисунки, иллюстрирующие
эти типы.Примеры таких работ приведены на следующих слайдах.