- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Интегрированный урок физики и биологии
Содержание
- 2. Девиз: “Чтобы познать, нужно научиться наблюдать!” Наблюдательность –
- 3. Жил один кристалл ионныйДля ионов дом огромный.Был
- 4. 6. Проводимости каких веществ мы еще не
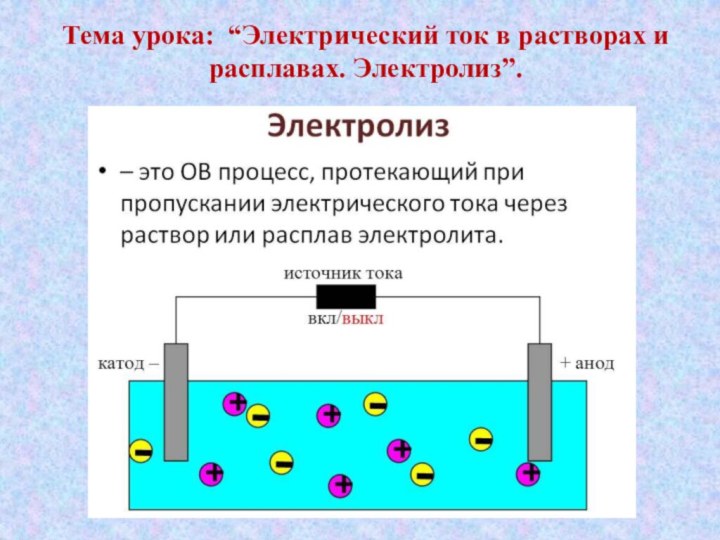
- 5. Тема урока: “Электрический ток в растворах и расплавах. Электролиз”.
- 7. это вещества, растворы и расплавы которыепроводят электрический ток.Электролиты -
- 8. «Честь науке - ей дано уменье, выводить
- 10. «Честь науке- ей дано уменье, выводить нас
- 11. Электролиз расплава NaBrI. В расплаве электролита
- 12. II. Электролиз водного раствора электролитаВ отличии от
- 13. ФизкультминуткаБыстро встали, улыбнулись,Выше-выше потянулись,Ну-ка плечи распрямите,Поднимите,
- 14. Закон Фарадея: -электрохимический эквивалент вещества(1)(2)(3)
- 15. Масса вещества, выделившегося на электроде, прямо пропорциональна заряду, прошедшему через раствор (расплав) электролита:m=kQ
- 16. Масса вещества, выделившегося на электроде, прямо
- 17. Согласно (3):(6)(6) – второй закон Фарадея(7)F- постоянная Фарадея(5)(4)
- 18. Объединенный закон Фарадея:
- 19. – английский физик, основоположник учения об электрических и магнитных полях. Майкл Фарадей (1711 – 1867)
- 20. Задача: При никелировании детали в течении 50 минут
- 21. А знаете ли вы, что…..Современную жизнь без электролиза представить себе уже невозможно….
- 22. Применение электролизаЭлектролизом расплавов природных соединений получают активные
- 23. При помощи электролиза монету можно покрыть тонким
- 24. Гальваностегия
- 25. Гальванопластика Медные клише для типографии
- 26. Пресс-формы из пластмассы, резины, металла
- 27. Получение металлов из руд
- 28. АНОДИРОВАНИЕ
- 30. Тест:1. При электролитической диссоциации в растворе электролита
- 31. Ответы: 1 – В, 2 – Б,
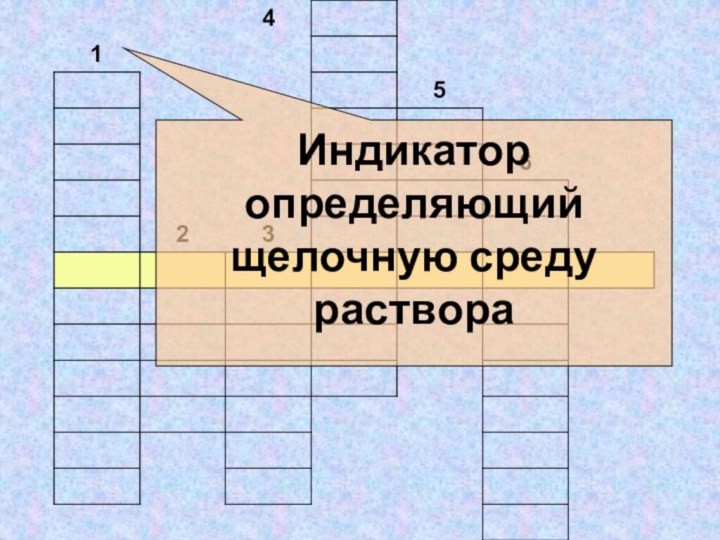
- 32. Индикатор определяющий щелочную среду раствора
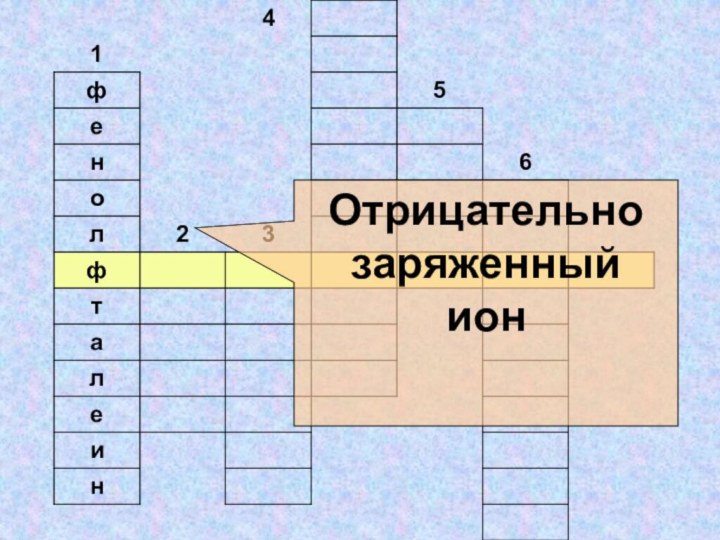
- 33. Отрицательно заряженныйион
- 34. Что образуется при растворении кристаллического вещества в воде?
- 35. процесс распада молекул электролита на ионы под действием электричес-кого тока
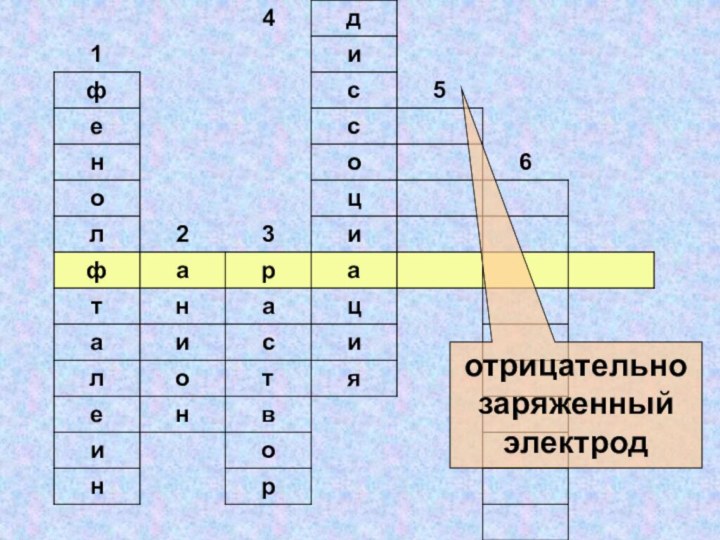
- 36. отрицательно заряженный электрод
- 37. отрицательно заряженный электрод
- 38. совокупность окислительно-восстановительных процессов, протекающих в растворах или расплавах электролитов под действием электрического тока
- 40. Будущее – получение цветных металлов, защита от
- 41. Домашнее задание§12.Подготовить сообщение по теме «Применение электролиза в различных сферах деятельности человека»Подготовить презентацию – «Электролиз»
- 42. Проверь себяПри электролизе водного раствора хлорида лития
- 43. Проверь себяПри электролизе водного раствора сульфата меди
- 44. Проверь себяУстановите соответствие между формулой соли ипродуктом,образующимся
- 45. Скачать презентацию
- 46. Похожие презентации
















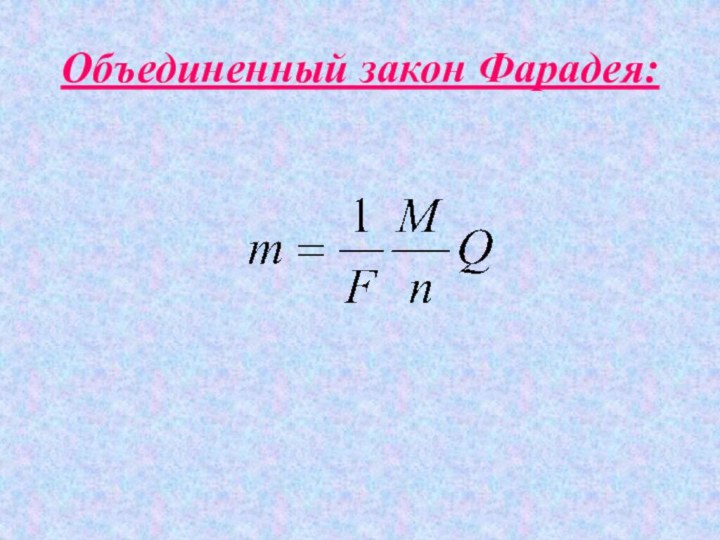























Слайд 2
Девиз: “Чтобы познать, нужно научиться наблюдать!”
Наблюдательность – это сосредоточенность,
Слайд 3
Жил один кристалл ионный
Для ионов дом огромный.
Был красивый
он и ровный,
Но случилась с ним беда.
Капля на
него упала и Кристалла вмиг не стало.
На ионы распластала его ловкая вода.
Все семейство удивилось.
Что снаружи приключилось?
Это разом появилось.
Слайд 4
6. Проводимости каких веществ мы еще не рассматривали?
1.
В каких состояниях может находится вещество?
2. На какие группы
делятся вещества по проводимости электрического тока?3. Какая проводимость в металлах?
4. Чем обусловлена собственная проводимость полупроводников?
5. Какая проводимость в газах?
Слайд 8 «Честь науке - ей дано уменье, выводить нас
из заблужденья».
М.Светлов
процесс распада молекул электролита на ионы в
растворе или расплаве.С.Аррениус
Электролитическая диссоциация -
Теория электролитической диссоциации. 1887 г.
Слайд 10 «Честь науке- ей дано уменье, выводить нас из
заблужденья».
2.Электролитическая диссоциация
Шведский ученый, академик.
В 1887 году
сформулировал основные положения теории электролитической диссоциации. В 1903 г. награжден Нобелевской премией.
Проводил исследования во многих других областях науки.
С.Аррениус
(1859 – 1927)
Слайд 11
Электролиз расплава NaBr
I. В расплаве электролита присутствуют
только ионы, образовавшиеся при его
диссоциации, они и участвуют в
окислительно-восстановительном процессе
Слайд 12
II. Электролиз водного раствора электролита
В отличии от расплава
в растворе электролита кроме ионов, получившихся при его диссоциации,
присутствуют еще и молекулыводы, а также ионы H+ и OH-
Слайд 13
Физкультминутка
Быстро встали, улыбнулись,
Выше-выше потянулись,
Ну-ка плечи распрямите,
Поднимите, опустите.
Вправо,
влево повернитесь,
Рук ладонями коснитесь.
Сели-встали, сели-встали.
Вы, надеюсь, не устали.
Физзарядка будет
впрок.Продолжаем наш урок
Слайд 15 Масса вещества, выделившегося на электроде, прямо пропорциональна заряду,
прошедшему через раствор (расплав) электролита:
m=kQ
Слайд 16
Масса вещества, выделившегося на электроде, прямо пропорциональна
силе тока и времени прохождения тока через раствор (расплав)
электролита:m=kIt
Учитывая, что Q = It, получим:
Слайд 19 – английский физик, основоположник учения об электрических и
магнитных полях.
Майкл Фарадей (1711 – 1867)
Слайд 20 Задача: При никелировании детали в течении 50 минут сила
тока, проходящего через ванну, была равна 2 А. Какова
масса, выделившегося вещества на детали, если электрохимический эквивалент никеля k = 3 · 10 – 7 кг/Кл?
Слайд 22
Применение электролиза
Электролизом расплавов природных соединений получают активные металлы
(K,
Na,Be,Ca,Ba …)
Электролизом растворов солей получают-
Zn, Cd, Co…..
Электролиз используют
для получения -F2, CL2, H2, O2, NaOH и ….
Слайд 23 При помощи электролиза монету можно покрыть тонким слоем
многих металлов .
Но первом фото монета покрыта слоем
цинка , на втором эта же монета , но она уже золотая , а на третьем фото она стала опять медной с красивым оттенком . Это одна и та же монета – копеечка 1924 года .
ЭТО ИНТЕРЕСНО…..
Слайд 30
Тест:
1. При электролитической диссоциации в растворе электролита присутствуют:
А)
молекулы, Б) ионы,
В) гидратированные ионы.2. Какая проводимость наблюдается в жидкостях?
А) электронная, Б) ионная, В) электронно-ионная
3. Чем отличается проводимость электролитов от проводимости в металлах?
А) ни чем, Б) в электролитах ионы, в металлах ионы и электроны, В) в электролитах – ионы, в металлах – электроны.
4. Каким ученым связано развитие гальванотехники:
А) М.Фарадей, Б) Б.Якоби, В) С.Аррениус
5. Задача. При силе тока 1,6 А на катоде выделилась медь массой 0,316 г за 10 минут. Найдите значение k меди.
Слайд 38 совокупность окислительно-восстановительных процессов, протекающих в растворах или расплавах
электролитов под действием электрического тока
Слайд 40 Будущее – получение цветных металлов, защита от коррозии,
источники постоянного тока. Слова Аррениуса: «Электрическая диссоциация будет применима
и полезна во всех областях современной науки».Имя – Диссоциация
Фамилия – Электролитическая
Год рождения – 1882 год
Место жительства – раствор электролитов
Родители – дед – С. Аррениус, отец – Фарадей
Характер поведения – вне поля – хаотичный, в электрическом поле – упорядоченный.
Значение – развитие цветной металлургии, инкрустация металлов, получение отслаиваемого покрытия.
Слайд 41
Домашнее задание
§12.
Подготовить сообщение по теме «Применение электролиза в
различных сферах деятельности человека»
Подготовить презентацию – «Электролиз»
Слайд 42
Проверь себя
При электролизе водного раствора хлорида лития (LiCL)
на аноде в результате электролиза образуется:
1) хлор
2) литий
3) кислород
4)
водород
Слайд 43
Проверь себя
При электролизе водного раствора сульфата
меди (II)
( CuSO4) на катоде выделится:
А) кислород
Б) водород
В) медь
Г) сера
Слайд 44
Проверь себя
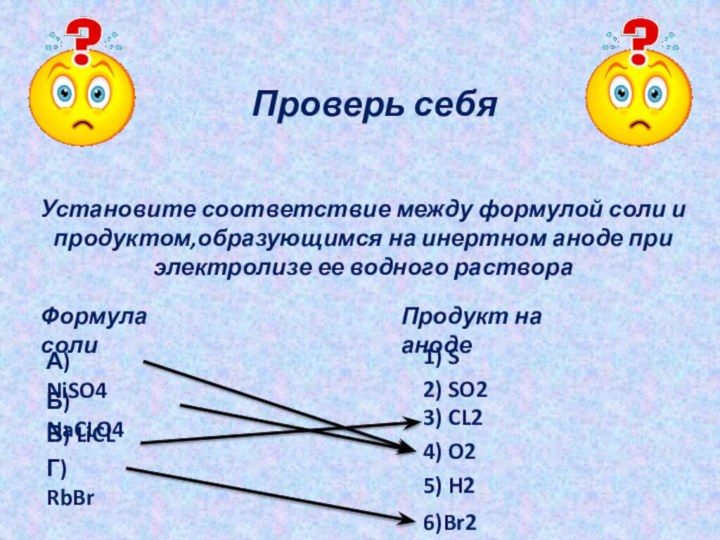
Установите соответствие между формулой соли и
продуктом,образующимся на
инертном аноде при электролизе ее водного раствора
Формула соли
Продукт на
анодеА) NiSO4
Б) NaCLO4
В) LiCL
Г) RbBr
1) S
2) SO2
3) CL2
4) O2
5) H2
6)Br2