- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Супрамолекулярные системы – мост между неживой и живой материей
Содержание
- 2. Вопросы входного контроля знаний:Дайте определения терминам: Атом;Молекула;Химическая
- 3. Химическая связь и строение молекул
- 4. Моле́кула — электрически нейтральная частица, образованная из двух
- 5. Химическая связь – это совокупность электронно-ядерных взаимодействий,
- 6. ХС образуется в результате ядерно-электронного взаимодействия: притяжение
- 7. Термодинамика процесса образования химической связи (ХС).Энтальпийный
- 8. Энтальпия — это термодинамическое свойство вещества, которое
- 9. ∆ G < 0 только если ∆Н
- 10. Метод валентных связей (ВС)Метод молекулярных орбиталей (МО)Представления
- 11. Основные положения теории валентных связей1. ХС между
- 12. 5. В пространстве ХС располагается в том
- 13. Ковалентность элемента или его спинвалентность определяется числом
- 14. Каждый атом дает по одному неспаренному электрону
- 15. Свойства ковалентной химической связи1. Энергия связи2. Длина связи3. Кратность связи4. Насыщаемость5. Направленность6. Полярность7. Поляризуемость
- 16. Влияние кратности связи на её энергию и длину
- 17. Насыщаемость связи – … II период –
- 18. Направленность ковалентной связи – …
- 19. Гибридизация – не физическое явление, а модель!
- 20. Полярность связи – … Чем ↑Δ ОЭО,
- 21. Cвязь в молекуле HCl полярная, имеет на 17% ионный характер.
- 22. т.е., степень ионности равна 83%. Полного перетягивания
- 23. Дипольный момент связи (μ)Эффективный зарядДлина связи
- 24. Неполярные молекулыМолекула неполярна, если суммарный μ всех связей = 0.
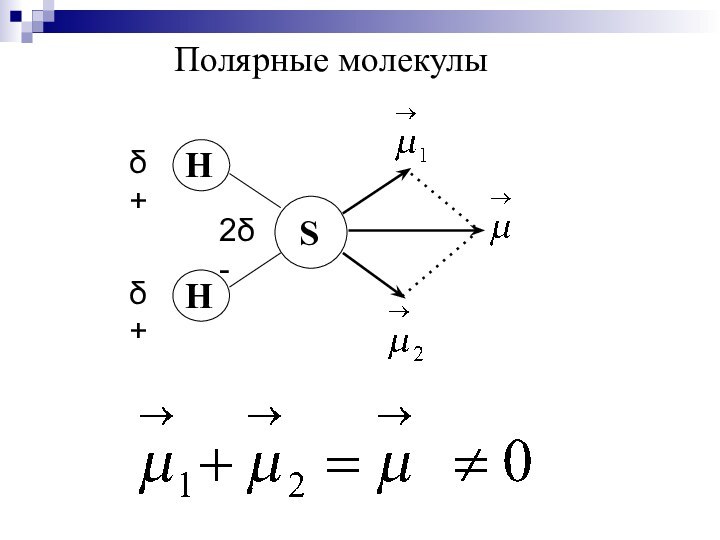
- 25. Полярные молекулы
- 26. Дипольный момент молекулы зависит от: ∙ полярности связей; ∙ геометрии молекулы; ∙ наличия неподелёных пар электронов.
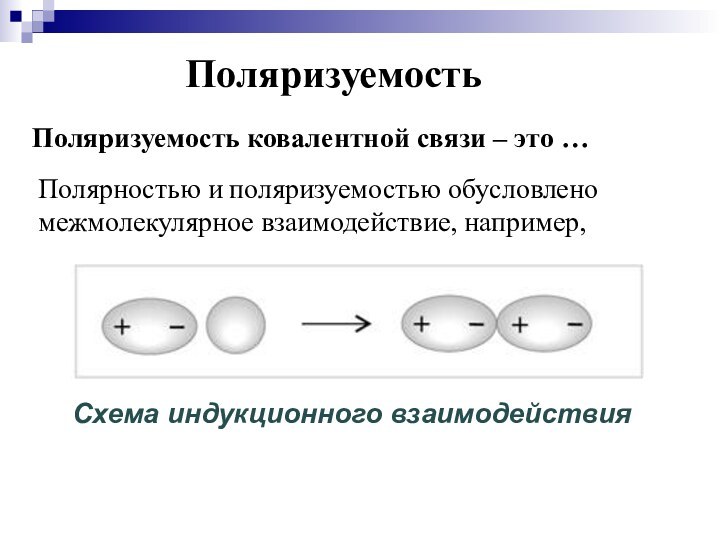
- 27. ПоляризуемостьПоляризуемость ковалентной связи – это …Полярностью и поляризуемостью обусловлено межмолекулярное взаимодействие, например,
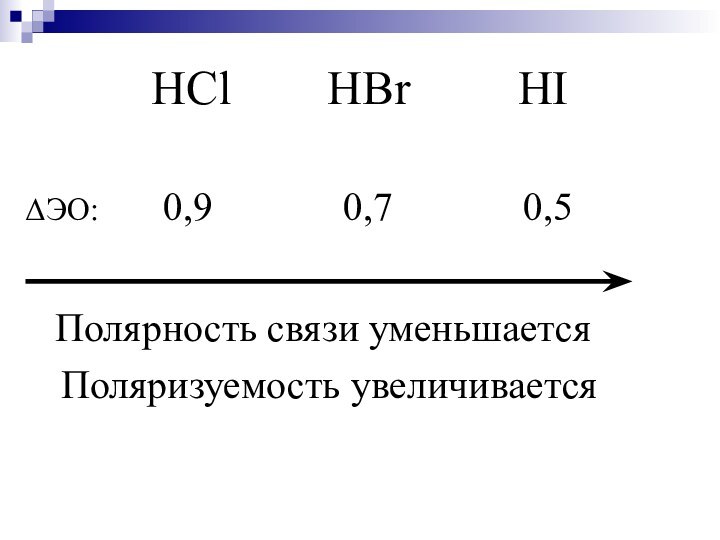
- 28. HCl HBr
- 30. Водородная связь
- 31. Структура молекулы воды (а), иона гидроксония (b)
- 32. Симметричные (а) и (b), и асимметричные гидроксогруппы
- 33. Водородная связьВеличины зарядов и длины ковалентной и водородных связей в воде на разделе фаз газ-жидкость.
- 34. Взаимодействие между молекулами НХ:сильно ЭО элемент: F,
- 35. Межмолекулярные водородные связи между нитями ДНК Внутримолекулярная
- 36. Механизм образования Н-связи: - Электростатическое взаимодействие (диполь-дипольное)-Донорно-акцепторное взаимодействие:-направленность-насыщаемость
- 37. Туннельные эффекты при образовании Н-связи: Туннельный эффект (туннелирование,
- 38. Например, для электрона, находящегося в потенциальной энергетической
- 39. Туннельные эффекты при образовании Н-связи: ТЭ при
- 40. В 1805 г. Теодор Гротгус выдвинул первое правильное
- 41. Есвязи, кДж/мольковалентная100-400водородная4-50межмолекулярная0,1 -5 Энергия Н-связи
- 42. Внутримолекулярные Н - связи
- 43. Основные положения методамолекулярных орбиталей (ММО)1. При образовании
- 44. 3.Для получения МО используют метод линейной комбинации
- 45. 6. Химическая связь в ММО характеризуется энергией
- 46. Наличие спаренных или неспаренных электронов в атомах,
- 47. Парамагнитные свойства
- 48. Сравнительная характеристика методов: ВС и МОВС достоинства:
- 49. МОдостоинства: ∙ общий подход при описании всех
- 50. Основные положения теории систем(синергетика)
- 51. Система – это совокупность элементов или
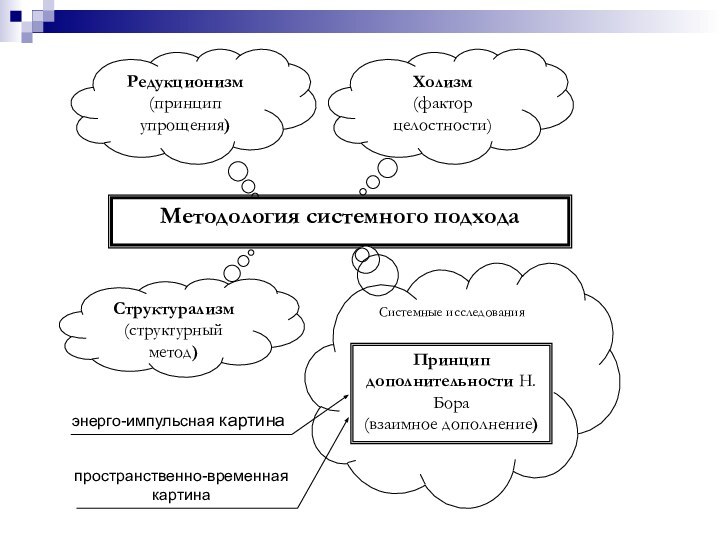
- 52. Редукционизм(принцип упрощения)Холизм(фактор целостности)Методология системного подходаСтруктурализм(структурный метод)Системные исследованияПринцип дополнительности Н.Бора(взаимное дополнение)
- 53. Редукция – упрощение, сведение более сложного к
- 54. Эмерджентность: 1 + 1 ≠ 2 От англ. emergent —
- 55. Основные принципы синергетикиПрирода иерархически структурирована в несколько
- 56. Основные принципы синергетикиОбщее для всех эволюционирующих систем:
- 57. Основные принципы синергетикиВ сильно неравновесных состояниях системы
- 58. Синергетика объясняет процесс самоорганизации в сложных системах
- 59. Синергетика объясняет процесс самоорганизации в сложных системах
- 60. Синергетика объясняет процесс самоорганизации в сложных системах
- 61. Синергетика объясняет процесс самоорганизации в сложных системах
- 62. Синергетика объясняет процесс самоорганизации в сложных системах
- 63. Самоорганизация в супрамолекулярных системах обусловлена: Различными видами
- 64. Движущие силы самоорганизации молекул и образование супрамолекулярных
- 65. Виды самоорганизации молекул Самоорганизация путем распознавания:Структура гость-хозяинПример
- 66. Виды самоорганизации молекул Самосборка комплементарных молекул:Пример –
- 67. Виды самоорганизации молекул Самосборка молекулярных кристаллов:Пример –
- 68. Виды самоорганизации молекул Внутримолекулярная перестройка:Пример – образование
- 69. Литература для самоподготовкиМолекулярная биология клетки : рук-во
- 70. Скачать презентацию
- 71. Похожие презентации


















































Слайд 2
Вопросы входного контроля знаний:
Дайте определения терминам:
Атом;
Молекула;
Химическая связь;
Энтропия;
Энтальпия;
Энергия
Гиббса;
связиСлайд 4 Моле́кула — электрически нейтральная частица, образованная из двух или
более связанных ковалентными связями атомов.
А́том (от др.-греч. ἄτομος —
неделимый, неразрезаемый) — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и электронов.Слайд 5 Химическая связь – это совокупность электронно-ядерных взаимодействий, приводящих
к минимуму потенциальной энергии системы.
Энергия ХС равна работе,
которую необходимо затратить, чтобы разделить молекулу на две части (атомы, группы атомов) и удалить их друг от друга на бесконечное расстояние.
Длина ХС – это расстояние между центрами ядер атомов, образующих связь.
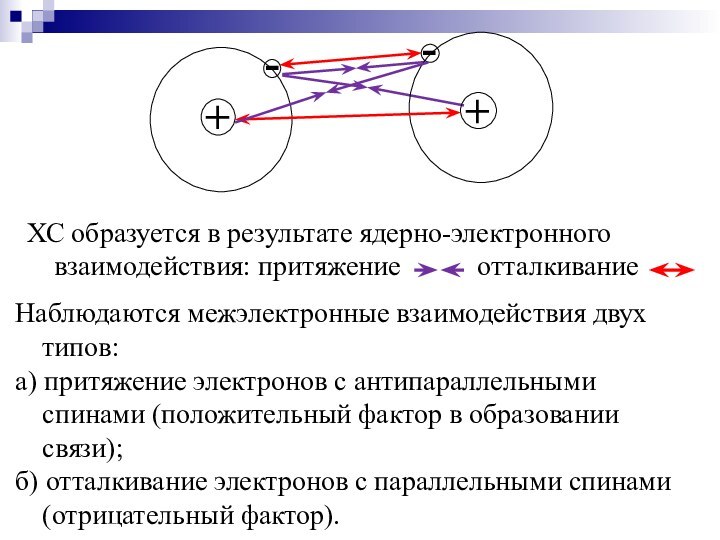
Слайд 6 ХС образуется в результате ядерно-электронного взаимодействия: притяжение
отталкивание
Наблюдаются межэлектронные взаимодействия двух
типов:а) притяжение электронов с антипараллельными спинами (положительный фактор в образовании связи);
б) отталкивание электронов с параллельными спинами (отрицательный фактор).
Слайд 7
Термодинамика процесса образования
химической связи (ХС).
Энтальпийный
фактор
Энтропийный
фактор
Процесс самопроизвольный, т.е. энергия Гиббса ∆ G
+ В → АВS1
S2
S1 > S2 ⇒ ∆S < 0
Т∆S < 0, а это не способствует образованию ХС.
Слайд 8 Энтальпия — это термодинамическое свойство вещества, которое указывает
уровень энергии, сохраненной в его молекулярной структуре. Это значит,
что, хотя вещество может обладать энергией на основании температуры и давления, не всю ее можно преобразовать в теплоту. Часть внутренней энергии всегда остается в веществе и поддерживает его молекулярную структуру. Часть кинетической энергии вещества недоступна, когда его температура приближается к температуре окружающей среды. Следовательно, энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении. Энтропи́я (от др.-греч. ἐντροπία — поворот, превращение) — функция состояния термодинамической системы, определяющая меру необратимого рассеивания энергии. Энтропия может интерпретироваться как мера неопределённости (неупорядоченности) некоторой системы, который может иметь разные исходы, а значит, и количество информации
Слайд 9
∆ G < 0 только если ∆Н
0
Основной причиной образования химических связей между атомами с образованием
молекулы является понижение полной энергии системы при переходе от свободных атомов к молекуле.
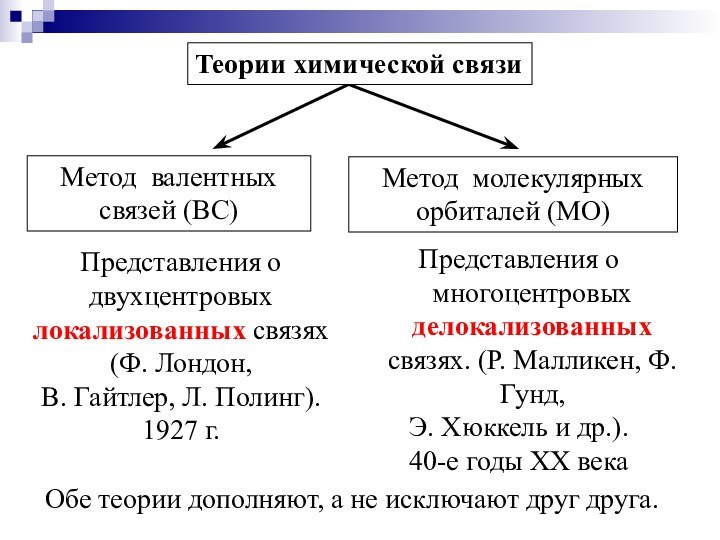
Слайд 10
Метод валентных
связей (ВС)
Метод молекулярных
орбиталей (МО)
Представления о
двухцентровых локализованных связях (Ф. Лондон,
В. Гайтлер, Л. Полинг).
1927
г. Представления о многоцентровых делокализованных связях. (Р. Малликен, Ф. Гунд,
Э. Хюккель и др.).
40-е годы ХХ века
Обе теории дополняют, а не исключают друг друга.
Теории химической связи
Слайд 11
Основные положения теории валентных связей
1. ХС между атомами
образуется в результате обобществления валентных электронов, т.е. образования общих
электронных пар.2. Общие электронные пары образуют лишь неспаренные электроны с антипараллельными спинами.
3. При образовании ХС происходит частичное перекрывание атомных орбиталей (АО), что приводит к увеличению электронной плотности в межъядерном пространстве.
4. ХС тем прочнее, чем в большей степени перекрываются взаимодействующие АО.
Слайд 12 5. В пространстве ХС располагается в том направлении,
в котором возможность перекрывания АО наибольшая.
6. ХС, образованная перекрыванием
АО по линии, соединяющей центры атомов, называется – σ- связью, а по обе стороны от линии - π-связью.Еσ > Еπ
7. Если молекула образуется путём перекрывания двух АО, связь называется одинарной, если более двух АО – кратной. Одинарная связь представлена всегда σ-связью, а кратные связи включают σ- и π-связи.
8.Общая электронная пара соответствует единице химической связи.
Основные положения теории ВС
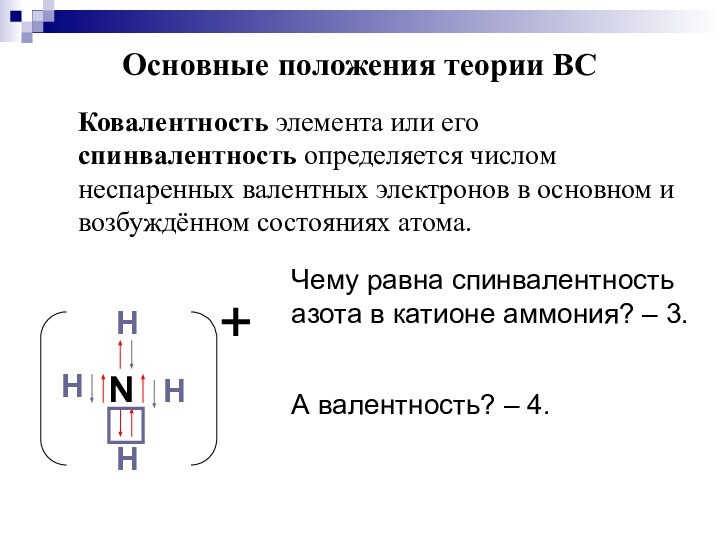
Слайд 13 Ковалентность элемента или его спинвалентность определяется числом неспаренных
валентных электронов в основном и возбуждённом состояниях атома.
Чему равна
спинвалентность азота в катионе аммония? – 3.А валентность? – 4.
Основные положения теории ВС
Слайд 14
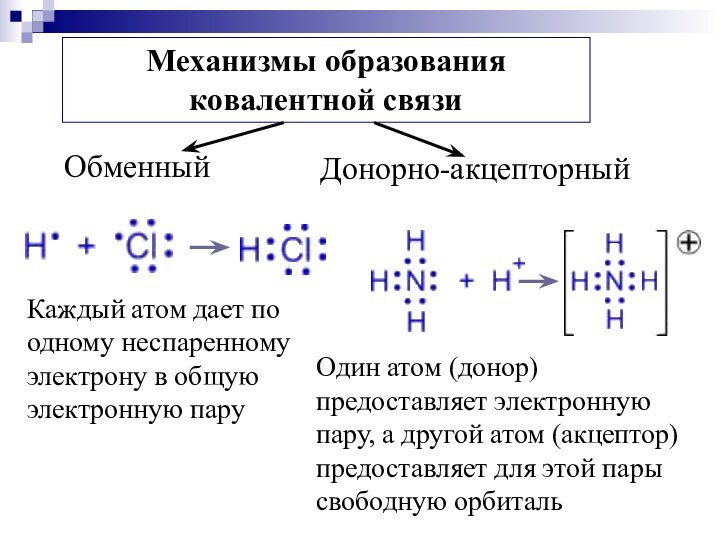
Каждый атом дает по одному неспаренному электрону в
общую электронную пару
Один атом (донор) предоставляет электронную пару,
а другой атом (акцептор) предоставляет для этой пары свободную орбиталь
Слайд 15
Свойства ковалентной химической связи
1. Энергия связи
2. Длина связи
3.
Кратность связи
4. Насыщаемость
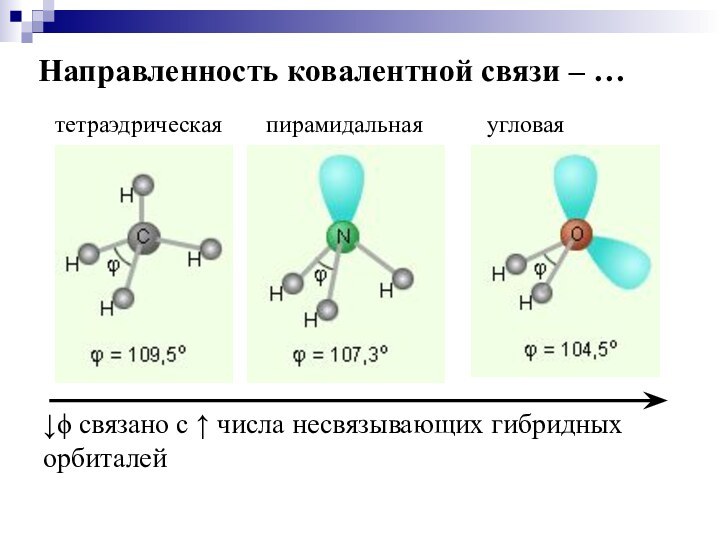
5. Направленность
6. Полярность
7. Поляризуемость
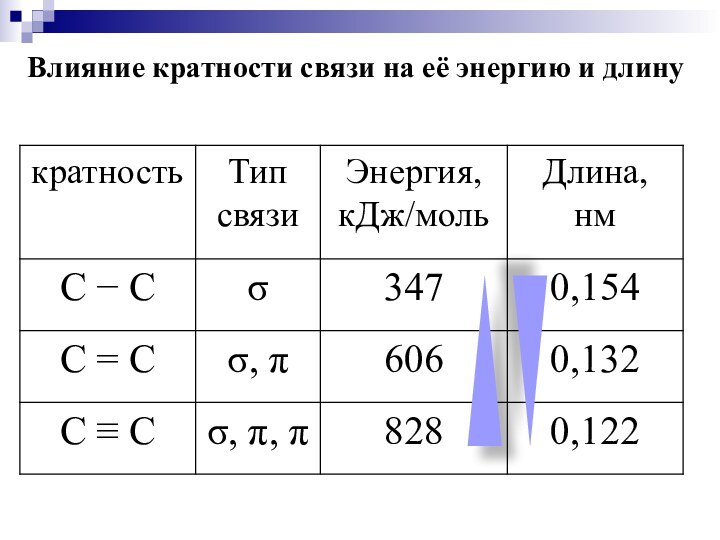
Слайд 17
Насыщаемость связи – …
II период – макс.
валентность не более IV
III период (s- и p-) –
макс. валентность не более IX (не всегда реализуется)
Максимальная валентность атома зависит от положения элемента в периодической системе.
Слайд 20
Полярность связи – …
Чем ↑Δ ОЭО, тем
↑ полярность х.с
Если ΔОЭО = 0 , то связь
ковалентная неполярная (H2 , Cl2, N2…). Если ΔОЭО ≈ 2,5-3,2 связь условно считают ионной и рассматривают как предельный случай ковалентной полярной связи.
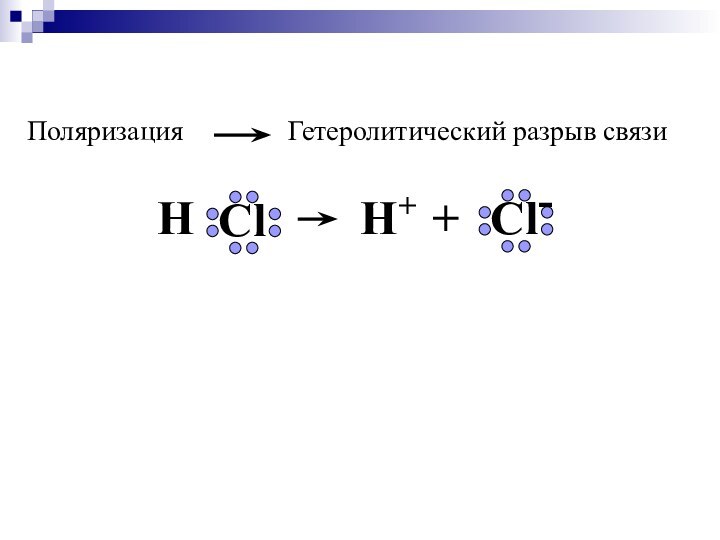
Слайд 22
т.е., степень ионности равна 83%.
Полного перетягивания связующих
пар электронов от более электроположительного к более электроотрицательному атому
и образования 100%-ной ионной связи практически не наблюдается.
Слайд 26
Дипольный момент молекулы зависит от:
∙ полярности связей;
∙ геометрии молекулы;
∙ наличия неподелёных пар электронов.
Слайд 27
Поляризуемость
Поляризуемость ковалентной связи – это …
Полярностью и поляризуемостью
обусловлено межмолекулярное взаимодействие, например,
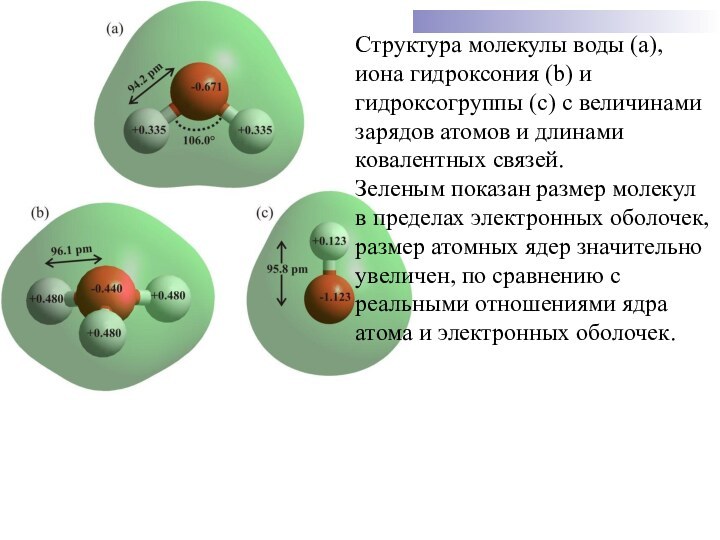
Слайд 31 Структура молекулы воды (а), иона гидроксония (b) и
гидроксогруппы (с) с величинами зарядов атомов и длинами ковалентных
связей.Зеленым показан размер молекул в пределах электронных оболочек,
размер атомных ядер значительно увеличен, по сравнению с реальными отношениями ядра атома и электронных оболочек.
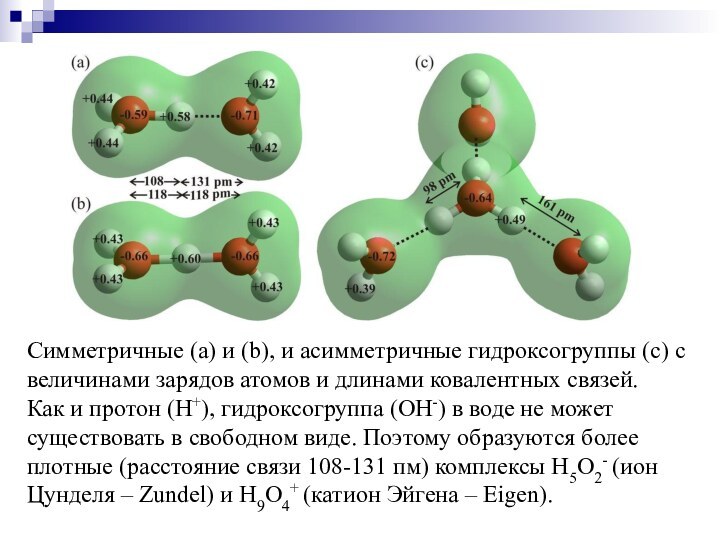
Слайд 32 Симметричные (а) и (b), и асимметричные гидроксогруппы (с)
с величинами зарядов атомов и длинами ковалентных связей.
Как и
протон (H+), гидроксогруппа (OH-) в воде не может существовать в свободном виде. Поэтому образуются более плотные (расстояние связи 108-131 пм) комплексы H5O2- (ион Цунделя – Zundel) и H9O4+ (катион Эйгена – Eigen).
Слайд 33
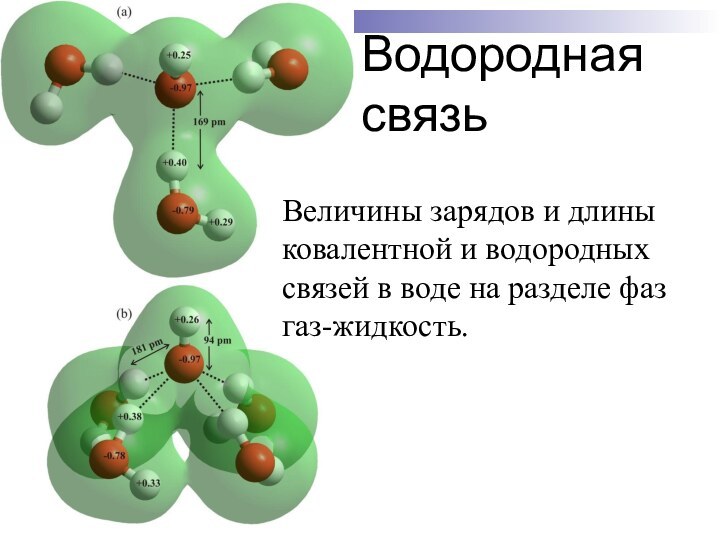
Водородная связь
Величины зарядов и длины ковалентной и водородных
связей в воде на разделе фаз газ-жидкость.
Слайд 34
Взаимодействие между молекулами НХ:
сильно ЭО элемент: F, O,
N, (Cl, S )
Водородные связи могут быть меж- и
внутримолекулярными.
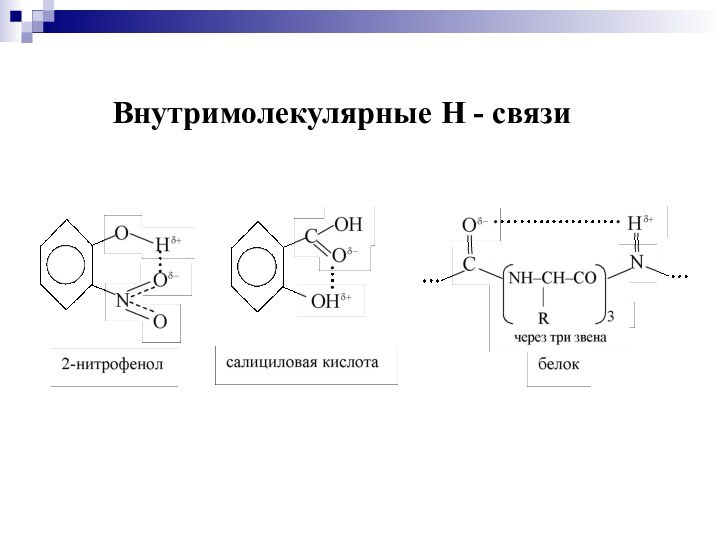
Слайд 35
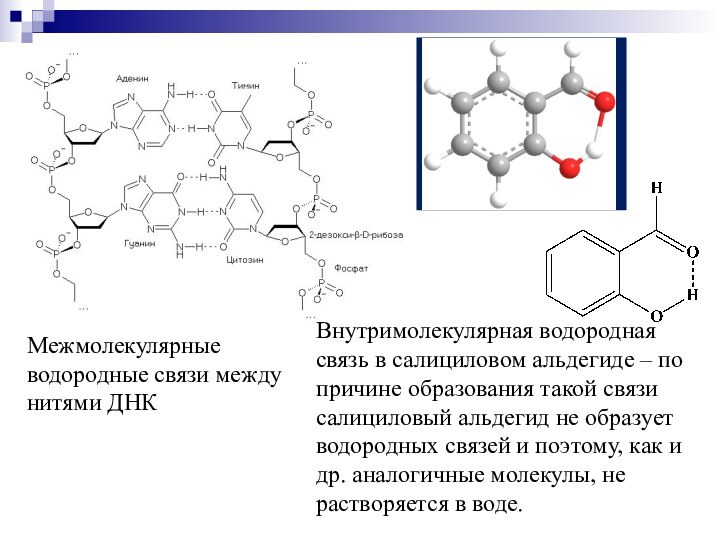
Межмолекулярные водородные связи между нитями ДНК
Внутримолекулярная водородная
связь в салициловом альдегиде – по причине образования такой
связи салициловый альдегид не образует водородных связей и поэтому, как и др. аналогичные молекулы, не растворяется в воде.
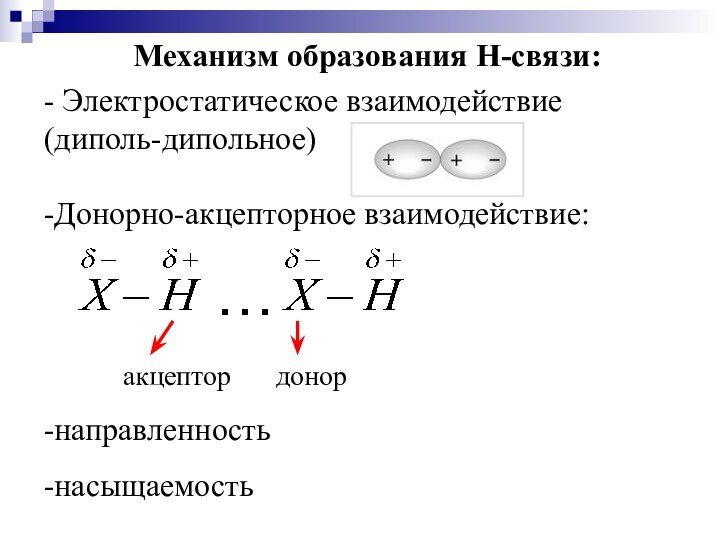
Слайд 36
Механизм образования Н-связи:
- Электростатическое взаимодействие (диполь-дипольное)
-Донорно-акцепторное взаимодействие:
-направленность
-насыщаемость
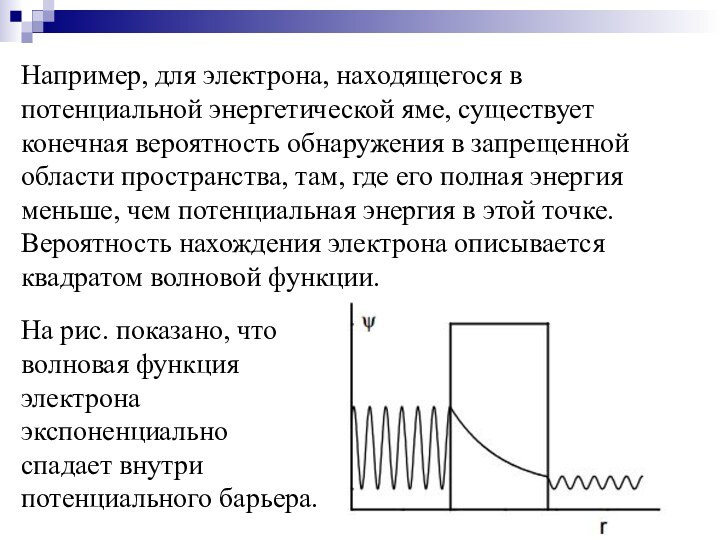
Слайд 37
Туннельные эффекты при образовании Н-связи:
Туннельный эффект (туннелирование, ТЭ)
– прохождение частицы (или системы частиц) сквозь область пространства,
пребывание в которой запрещено классической механикой.Слайд 38 Например, для электрона, находящегося в потенциальной энергетической яме,
существует конечная вероятность обнаружения в запрещенной области пространства, там,
где его полная энергия меньше, чем потенциальная энергия в этой точке. Вероятность нахождения электрона описывается квадратом волновой функции.На рис. показано, что волновая функция электрона экспоненциально спадает внутри потенциального барьера.
Слайд 39
Туннельные эффекты при образовании Н-связи:
ТЭ при образовании
водородной связи, возможно, наблюдается в трехмерной сетке водородных связей
воды при образовании ионов H3O+ и H3O2– вследствие «хаотичного» перемещения протонов по сетке водородных связей.При этом, при образовании H3O+ покинуть молекулу воды равновероятно может любой из трех протонов, а не только тот, который пришел, по этой причине направление туннелирования протона не предсказуемо.
Слайд 40 В 1805 г. Теодор Гротгус выдвинул первое правильное теоретическое
объяснение разложения воды электрическим током и сформулировал первую теорию
электролиза, основным постулатом которой была идея о полярности корпускул, инициируемой электрическим током либо возникающей в результате взаимной электризации атомов. Описанный им принцип перемещения ионов водорода с опорой на молекулы воды называют «механизмом Гротгуса».Механизм Гротгуса доказан только в 2015 г. С уточнением –
Гротгус, считал, что ток распространяется по прямым линиям.
В расчетном эксперименте было доказано, что перемещение протонов происходит путем туннелирования преимущественно по кольцевым траекториям.
20 января 1785 г. – 26 марта 1822 г.
Механизм электропроводности воды по Гротгусу
Кристиан Иоганн Дитрих фон Гротгус (с 1805 известен как Теодор Гротгус)
Слайд 43
Основные положения метода
молекулярных орбиталей (ММО)
1. При образовании молекулы
по ММО изменяют своё состояние не только валентные электроны,
а все электроны соединяемых атомов. Они переходят с АО (одно ядро, одноцентровые) на более сложные многоцентровые - МО.2. МО – это объём пространства в поле нескольких ядер, где вероятность нахождения электронов составляет 90-95%
Слайд 44 3.Для получения МО используют метод линейной комбинации атомных
орбиталей МЛКАО. Из двух АО разных атомов образуется две
МО:а) связывающая, которая характеризуется меньшим запасом энергии по сравнению с запасом энергии АО;
б) разрыхляющая – с большим запасом энергии.
4. Число МО равно сумме АО соединяемых атомов.
Например, для молекулы Н2О:
2АО(Н) + 8АО(О) = 10МО.
5. Распределение электронов на МО молекулы подчиняется тем же правилам, что и по АО в атоме (принцип мин. полной энергии молекулы, запрет Паули, правило Гунда).
Слайд 45 6. Химическая связь в ММО характеризуется энергией связи
и кратностью. Кратность связи (р) определяется по формуле:
Если р
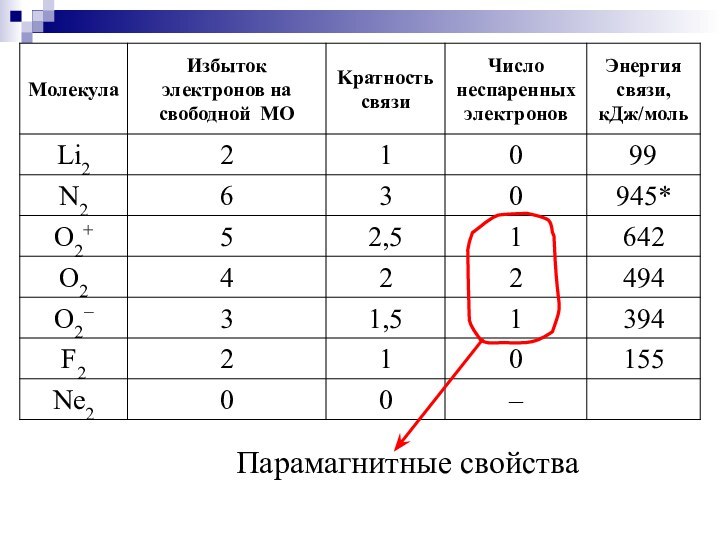
> 0, то химическая связь реализуется, тем больше энергия и прочность связи.Слайд 46 Наличие спаренных или неспаренных электронов в атомах, молекулах
и кристаллах устанавливается экспериментально путем изучения магнитных свойств вещества.
Если вещество выталкивается из внешнего неоднородного магнитного поля, то атомы этого вещества называют диамагнитными. Если вещество втягивается во внешнее неоднородное магнитное поле, то атомы этого вещества называют парамагнитными. Диамагнитные свойства вызваны движением спаренных электронов, а парамагнитные – движением неспаренных электронов. Чем больше у атома неспаренных электронов, тем в большей степени проявляется парамагнетизм у вещества.
Слайд 48
Сравнительная характеристика
методов: ВС и МО
ВС
достоинства:
нагляден;
описывает геометрию молекул
недостатки:
∙ не рассматривает вклад неспаренных
электронов в образовании связи (природу связи в частице Н2+); ∙ не может объяснить магнитные свойства вещества (например парамагнитные свойства О2)
Слайд 49
МО
достоинства:
∙ общий подход при описании всех химических
соединений;
Выбор метода определяется объектом исследования и поставленной задачей
недостатки:
∙ ненагляден;
∙ не объясняет геометрии молекул
Слайд 51 Система – это совокупность элементов или отношений,
закономерно связанных друг с другом в единое целое, которое
обладает свойствами, отсутствующими у элементов (эмерджентность).2) Система – комплекс элементов, находящихся во взаимодействии и единстве (Л. Берталанфи).
Слайд 52
Редукционизм
(принцип упрощения)
Холизм
(фактор целостности)
Методология системного подхода
Структурализм
(структурный метод)
Системные исследования
Принцип дополнительности
Н.Бора
(взаимное дополнение)
Слайд 53 Редукция – упрощение, сведение более сложного к простому,
обозримому, понимаемому, более доступному для анализа или решения, ослабление
чего-либо.Холизм – идеалистическое учение, рассматривающее мир как результат творческой эволюции, которая направляется нематериальным «фактором целостности».
Структурализм – выявление структуры как относительно устойчивой совокупности отношений («Функция без структуры немыслима, структура без функции – безсмысленна», В.Х. Василенко, академик РАМН СССР).
Принцип дополнительности (сформулирован Н. Бором) – при экспериментальном исследовании микрообъекта могут быть получены точные данные либо об его энергии, либо о поведении в пространстве и времени (координатах).
Слайд 54
Эмерджентность: 1 + 1 ≠ 2
От англ. emergent — возникающий,
неожиданно появляющийся, в теории систем — наличие у какой-либо системы особых
свойств, не присущих её подсистемам и блокам, а также сумме элементов; несводимость свойств системы к сумме свойств её компонентов; синоним — «системный эффект».То есть, система есть целостность с новыми качествами, функциями и признаками, отсутствующими у системообразующих элементов — отдельно взятые атомы не есть молекула. Связавшись в молекулу атомы образуют новую целостность, не обладающую свойствами атомов. При образовании молекул из атомов у них появляется масса, отсутствующих у отдельных атомов.
Слайд 55
Основные принципы синергетики
Природа иерархически структурирована в несколько видов
открытых нелинейных систем разных уровней организации: в динамически стабильные,
адаптивные, и наиболее сложные — эволюционирующие системы.Связь между ними осуществляется через хаотическое, неравновесное состояние систем соседствующих уровней.
Неравновесность является необходимым условием появления новой организации, нового порядка, новых систем, то есть — развития.
Когда нелинейные динамические системы объединяются, новое образование не равно сумме частей, а образует систему другой организации или систему иного уровня.
Слайд 56
Основные принципы синергетики
Общее для всех эволюционирующих систем: неравновесность,
спонтанное образование новых микроскопических (локальных) образований, изменения на макроскопическом
(системном) уровне, возникновение новых свойств системы, этапы самоорганизации и фиксации новых качеств системы.При переходе от неупорядоченного состояния к состоянию порядка все развивающиеся системы ведут себя одинаково (в том смысле, что для описания всего многообразия их эволюций пригоден обобщённый математический аппарат синергетики).
Развивающиеся системы всегда открыты и обмениваются энергией и веществом с внешней средой, за счёт чего и происходят процессы локальной упорядоченности и самоорганизации.
Слайд 57
Основные принципы синергетики
В сильно неравновесных состояниях системы начинают
воспринимать те факторы воздействия извне, которые они бы не
восприняли в более равновесном состоянии.В неравновесных условиях относительная независимость элементов системы уступает место корпоративному поведению элементов: вблизи равновесия элемент взаимодействует только с соседними, вдали от равновесия — «видит» всю систему целиком и согласованность поведения элементов возрастает.
В состояниях, далёких от равновесия, начинают действовать бифуркационные механизмы — наличие кратковременных точек раздвоения перехода к тому или иному относительно долговременному режиму системы — аттрактору. Заранее невозможно предсказать, какой из возможных аттракторов займёт система.
Слайд 58 Синергетика объясняет процесс самоорганизации в сложных системах следующим
образом:
Система должна быть открытой. Закрытая система в соответствии
с законами термодинамики должна в конечном итоге прийти к состоянию с максимальной энтропией и прекратить любые эволюции.Открытая система должна быть достаточно далека от точки термодинамического равновесия. В точке равновесия сколь угодно сложная система обладает максимальной энтропией и не способна к какой-либо самоорганизации. В положении, близком к равновесию и без достаточного притока энергии извне, любая система со временем ещё более приблизится к равновесию и перестанет изменять своё состояние.
Слайд 59 Синергетика объясняет процесс самоорганизации в сложных системах следующим
образом:
Фундаментальным принципом самоорганизации служит возникновение нового порядка и
усложнение систем через флуктуации (случайные отклонения) состояний их элементов и подсистем. Такие флуктуации обычно подавляются во всех динамически стабильных и адаптивных системах за счёт отрицательных обратных связей, обеспечивающих сохранение структуры и близкого к равновесию состояния системы. Но в более сложных открытых системах, благодаря притоку энергии извне и усилению неравновесности, отклонения со временем возрастают, накапливаются, вызывают эффект коллективного поведения элементов и подсистем и, в конце концов, приводят к «расшатыванию» прежнего порядка и через относительно кратковременное хаотическое состояние системы приводят либо к разрушению прежней структуры, либо к возникновению нового порядка. Поскольку флуктуации носят случайный характер, то состояние системы после бифуркации обусловлено действием суммы случайных факторов.Слайд 60 Синергетика объясняет процесс самоорганизации в сложных системах следующим
образом:
Самоорганизация, имеющая своим исходом образование через этап хаоса нового
порядка или новых структур, может произойти лишь в системах достаточного уровня сложности, обладающих определённым количеством взаимодействующих между собой элементов, имеющих некоторые критические параметры связи и относительно высокие значения вероятностей своих флуктуаций. В противном случае эффекты от синергетического взаимодействия будут недостаточны для появления коллективного поведения элементов системы и тем самым возникновения самоорганизации. Недостаточно сложные системы не способны ни к спонтанной адаптации ни, тем более, к развитию и при получении извне чрезмерного количества энергии теряют свою структуру и необратимо разрушаются.Слайд 61 Синергетика объясняет процесс самоорганизации в сложных системах следующим
образом:
Этап самоорганизации наступает только в случае преобладания положительных обратных
связей, действующих в открытой системе, над отрицательными обратными связями. Функционирование динамически стабильных, неэволюционирующих, но адаптивных систем — а это и гомеостаз в живых организмах и автоматические устройства — основывается на получении обратных сигналов от рецепторов или датчиков относительно положения системы и последующей корректировки этого положения к исходному состоянию исполнительными механизмами. В самоорганизующейся, в эволюционирующей системе возникшие изменения не устраняются, а накапливаются и усиливаются вследствие общей положительной реактивности системы, что может привести к возникновению нового порядка и новых структур, образованных из элементов прежней, разрушенной системы. Таковы, к примеру, механизмы фазовых переходов вещества или образования новых социальных формаций.Слайд 62 Синергетика объясняет процесс самоорганизации в сложных системах следующим
образом:
Самоорганизация в сложных системах, переходы от одних структур
к другим, возникновение новых уровней организации материи сопровождаются нарушением симметрии. При описании эволюционных процессов необходимо отказаться от симметрии времени, характерной для полностью детерминированных и обратимых процессов в классической механике. Самоорганизация в сложных и открытых — диссипативных системах, к которым относится и жизнь, и разум, приводят к необратимому разрушению старых и к возникновению новых структур и систем, что наряду с явлением неубывания энтропии в закрытых системах обуславливает наличие «стрелы времени» в Природе.
Слайд 63
Самоорганизация в супрамолекулярных системах обусловлена:
Различными видами электростатического
взаимодействия макромолекул по принципам комплементарности и трехмерной конгруэнтности обобществленных
электромагнитных оболочек.Трехмерным взаимодействиям размерно подходящих друг другу молекул по принципу гость-хозяин.
Структурная устойчивость и воспроизводимость супрамолекулярных комплексов обеспечивается тем, что супрамолекулярная система имеет меньшую энергию, чем суммарная энергия отдельно взятых молекул, образующих супрамолекулярную систему. Поэтому приток дополнительной энергии разрушает систему.
Слайд 64 Движущие силы самоорганизации молекул и образование супрамолекулярных систем
Для образования устойчивой супрамолекулярной системы (комплексов, агрегатов, кластеров) из
молекул необходимо выполнения двух условий:Между молекулами должно существовать взаимодействие,
У молекул, участвующих в образовании супрамолекулярной системы, должна быть возможность перемещаться в пространстве (трансляционная или/и вращательная диффузия). Первое условие определяет структуру, «жесткость» и стабильность супрамолекулярной системы, второе – возможность создать супрамолекулярную систему и динамику процессов образования такой системы.
В отсутствии диффузии супрамолекулярные системы не образуются.
Слайд 65
Виды самоорганизации молекул
Самоорганизация путем распознавания:
Структура гость-хозяин
Пример –
субстрат в активном центре фермента
Наведенное взаимодействие
Пример сборка активного центра
фермента при взаимодействии субстрата и фермента – субстрат является причиной организации активного центра в рабочую конформацию.
Слайд 66
Виды самоорганизации молекул
Самосборка комплементарных молекул:
Пример – образование
двойной нити ДНК. При нагревании (плавлении) ДНК она распадается
на две независимые нити, понижение температуры ниже критической точки плавления ДНК соповрождается быстрым восстановлением двуспиральной структуры, которая энергетически более выгодна, поскольку не содержит свободных водородных связей.
Слайд 67
Виды самоорганизации молекул
Самосборка молекулярных кристаллов:
Пример – образование
тубулиновых микрофиламентов и амилоида. Структурные единицы (короткоцепочечные пептиды) в
трехмерном пространстве собираются таким образом, что атомы с одинаковыми номерами в цепи пептида оказываются строго друг напротив друга – как в кристалле, в результате происходит быстрое наращивание нанотрубки с двух ее концов. Длина трубки зависит либо от количества структурных единиц, либо от пространственного ограничения (расти больше некуда), либо от жесткости нанотрубки – слишком длинная трубка ломается, а обломки служат затравкой для роста новых кристаллов.
Слайд 68
Виды самоорганизации молекул
Внутримолекулярная перестройка:
Пример – образование амилоида
и прионовых белков.
В условиях неблагоприятного молекулярного окружения (критическая
величина ионной силы среды, привносящая дополнительную энергию в систему) пептид перестраивается из альфа-спирали в бета-лист, являющийся более энергетически выгодной конформацией, чем альфа-спираль.В случае инфекционных прионов наблюдается перестройка нормальных белков в аномальные аномальным приновым белком – аутокатализ.
В случае амилоида – рост одномерных амилоидных кристаллов.