- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Типы химических реакций 8 класс
Содержание
- 2. Д.И. Менделеев«Мощь и сила науки во множестве фактов, цель – в обобщении этого множества»
- 3. «Типы химических реакций»Тема урока:
- 4. 1) Н2О → Н2↑ + О2↑2) Zn
- 5. Типы химических реакцийРеакция разложенияРеакция соединенияРеакция замещенияРеакция обмена
- 6. Что общего в данных реакциях?2Н2О = 2Н2↑
- 7. Лабораторный опыт № 12Н2О2 = 2Н2О +
- 8. Реакция разложения-реакция, в результате которой из одного
- 9. Что общего в данных реакциях?2Mg + O2
- 10. 2Мg + O2 =
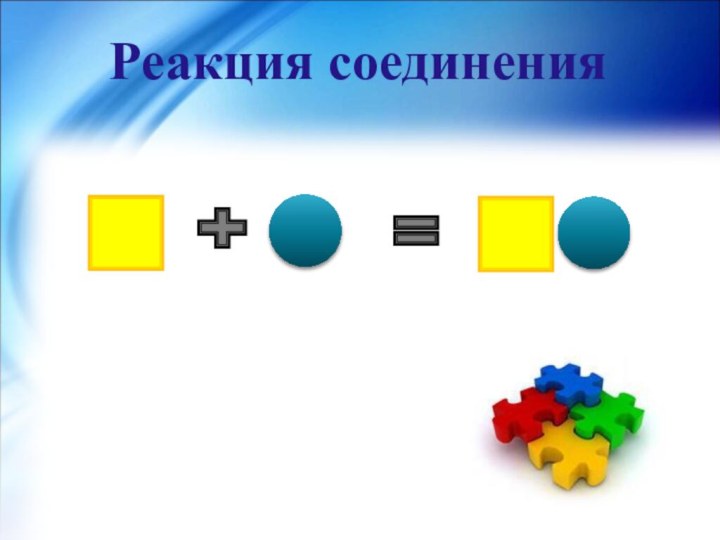
- 11. Реакция соединения-реакция, в результате которой из двух
- 12. Что общего в данных реакциях?Zn + 2HCl
- 13. Лабораторный опыт № 2↓Fe + CuSO4 →
- 14. Реакция замещения-реакция между простым и сложным веществами,
- 15. Реакция разложения
- 16. Реакция соединения
- 17. Реакция замещения
- 18. физминутка
- 19. Что общего в данных реакциях? HCl +
- 20. Реакция обмена - реакция между сложными
- 21. 1) Н2О → Н2↑ + О2↑2) Zn
- 22. 1 вариант1) Al + S= Al2S32) Fe
- 23. 1 вариант1) 2Al + 3S= Al2S3
- 24. самостоятельноAl + Fe2O3 = Al2O3 + FeNa
- 25. 2Al + Fe2O3 = Al2O3 + 2Fe
- 26. РефлексияОцените свою работу на уроке с позиции:
- 27. § 21 На «3» - упр.1 (по
- 28. Скачать презентацию
- 29. Похожие презентации
Д.И. Менделеев«Мощь и сила науки во множестве фактов, цель – в обобщении этого множества»



























Слайд 4
1) Н2О → Н2↑ + О2↑
2) Zn +
HCl → ZnCl2 + H2↑
3) Mg + O2 →
MgO4) CuCl2 + NaOH → NaCl + Cu(OH)2
Расставьте коэффициенты
в схемах химических реакций
К какому типу относят каждую реакцию?
Слайд 6
Что общего в данных реакциях?
2Н2О = 2Н2↑ +
О2↑
2KMnO4 = K2MnO4 + MnO2 + O2↑
CaCO3 = CaO
+ CO2↑ Cu(OH)2 = CuO + H2O
Слайд 7
Лабораторный опыт № 1
2Н2О2 = 2Н2О + О2
1)
Данная реакция протекает в присутствии катализатора МnO2 (или при
длительном нагревании).2) Признаки реакции: выделение газа.
3) Тип реакции: реакция разложения.
МnO2
Прозрачная бесцветная
жидкость
Слайд 8
Реакция разложения-
реакция, в результате которой
из одного сложного
вещества образуются два или несколько простых или сложных веществ.
Слайд 9
Что общего в данных реакциях?
2Mg + O2 =
2MgO
BaO + H2O = Ba(OH)2
Fe + S =FeS
4NO2 +2H2O
+ O2 = 4HNO3
Слайд 10
2Мg + O2 = 2MgO
1)
Данная реакция сопровождается выделением тепла и света
2) Признак реакции:
яркая вспышка3) Тип реакции: реакция соединения.
Белый
серебристый
Слайд 11
Реакция соединения-
реакция, в результате которой из двух или
нескольких простых или сложных веществ образуется одно более сложное
вещество.
Слайд 12
Что общего в данных реакциях?
Zn + 2HCl =
ZnCl2 + H2↑
H2 + CuO = H2O + Cu
Fe
+ CuCl2 = FeCl2 + Cu2Al + Fe2O3 = Al2O3 + 2Fe
Слайд 13
Лабораторный опыт № 2
↓
Fe + CuSO4 → FeSO4
+ Cu
голубой раствор
Зеленый раствор
Красный цвет
1) Данная реакция протекает
при соприкосновении веществ.2) Признаки реакции: изменение окраски; образование осадка.
3) Тип реакции: реакция замещения.
Слайд 14
Реакция замещения-
реакция между простым и сложным веществами,
в
результате которой
атомы простого вещества замещают атомы одного из
элементов в сложном веществе.
Слайд 19
Что общего в данных реакциях?
HCl + NaOH =
H2O + NaCl
Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3
K2S
+ 2HCl = 2KCL + H2SСлайд 20 Реакция обмена - реакция между сложными веществами, в
результате которой
они обмениваются своими составными частями.
Слайд 21
1) Н2О → Н2↑ + О2↑
2) Zn +
HCl → ZnCl2 + H2↑
3) Mg + O2 →
MgO4) CuCl2 + NaOH → NaCl + Cu(OH)2
Расставьте коэффициенты
в схемах химических реакций
К какому типу относят каждую реакцию?
Слайд 22
1 вариант
1) Al + S= Al2S3
2) Fe +
HCl = FeCl2 +H2
2 вариант
Al + CuBr2 = AlBr3 + Cu
CuOH = Cu2O + H2O
Подберите коэффициенты и определите типы реакций
Слайд 23
1 вариант
1) 2Al + 3S= Al2S3
Р. СОЕДИНЕНИЯ
2) Fe + 2HCl = FeCl2 +H2 Р. ЗАМЕЩЕНИЯ
2 вариант
2Al + 3CuBr2 = 2AlBr3 +3Cu Р. ЗАМЕЩЕНИЯ
2CuOH = Cu2O + H2O Р. РАЗЛОЖЕНИЯ
проверка
Слайд 24
самостоятельно
Al + Fe2O3 = Al2O3 + Fe
Na +
Cl2 = NaCl
CuCl2 + Al = AlCl3 + Cu
Fe(OH)3
= Fe2O3 +H2O
Слайд 25
2Al + Fe2O3 = Al2O3 + 2Fe
р.замещения
2Fe(OH)3 = Fe2O3 +3H2O р.разложения
3CuCl2 + 2Al =
2AlCl3 + 3Cu р.замещения2Na + Cl2 = 2NaCl р.соединения
критерии оценивания:«5»- все верно
«4»- в одном уравнении неверно расставлены коэффициенты, но верно определен тип реакции; (или наоборот)
«3» - неверны коэф-ты, но верны типы ХР в 2-х уравнениях