- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности
Содержание
- 2. Фосфор.Фосфор — один из самых распространённых элементов
- 3. Физические свойства.Элементарный фосфор в обычных условиях представляет
- 4. Химические свойства.Химическая активность фосфора значительно выше, чем
- 5. Разновидности фосфора.Белый фосфор представляет собой белое вещество
- 6. Жёлтый фосфор.Неочищенный белый фосфор обычно называют «жёлтый
- 7. Красный фосфор.Красный фосфор, также называемый фиолетовым фосфором,
- 8. На воздухе красный фосфор воспламеняется при высоких
- 9. Чёрный фосфор.Чёрный фосфор — это наиболее стабильная
- 10. Металлический фосфор.При 8,3·1010 Па чёрный фосфор переходит
- 11. Взаимодействие с простыми веществами.Фосфор легко окисляется кислородом:4P
- 12. Скачать презентацию
- 13. Похожие презентации
Фосфор.Фосфор — один из самых распространённых элементов земной коры, его содержание составляет 0,1 % её массы. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 миниралов, важнейшими из которых являются апатит Ca5(PO4)3F, фосфорит Ca3(PO4)2











Слайд 3
Физические свойства.
Элементарный фосфор в обычных условиях представляет собой
несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора сложен и
до конца не решён. Обычно выделяют четыре модификации простого вещества — белую, красную, черную и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений — также металлическая форма. Все модификации различаются по цвету, плотности и другим физическим характеристикам; заметна тенденция к резкому убыванию химической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств
Слайд 4
Химические свойства.
Химическая активность фосфора значительно выше, чем у
азота. Химические свойства фосфора во многом определяются его аллотропной
модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов.В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Слайд 5
Разновидности фосфора.
Белый фосфор представляет собой белое вещество (из-за
примесей может иметь желтоватый оттенок) с температурой плавления 44,1 °С.
По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах. Химически белый фосфор чрезвычайно активен. Например, белый фосфор медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией или устаревшим термином — фосфоресценцией. Белый фосфор не только активен химически, но и весьма ядовит (вызывает поражение костей, костного мозга, некроз челюстей) и легкорастворим в органических растворителях. Летальная доза белого фосфора для взрослого мужчины составляет 0,05—0,1 г. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³.
Слайд 6
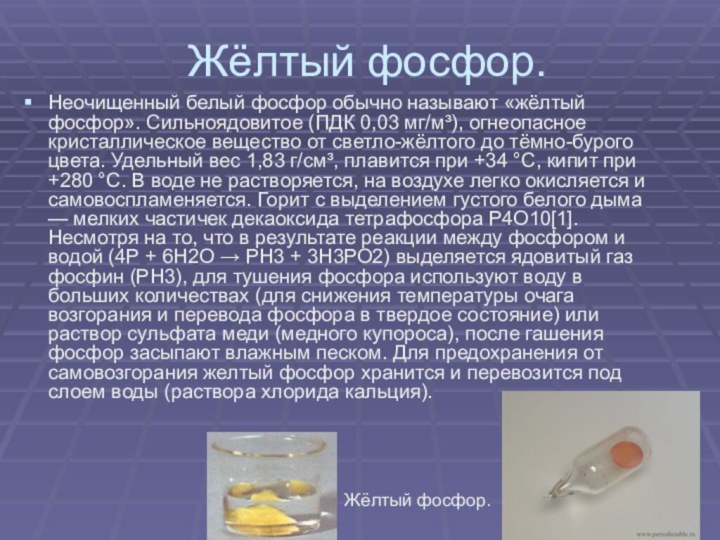
Жёлтый фосфор.
Неочищенный белый фосфор обычно называют «жёлтый фосфор».
Сильноядовитое (ПДК 0,03 мг/м³), огнеопасное кристаллическое вещество от светло-жёлтого
до тёмно-бурого цвета. Удельный вес 1,83 г/см³, плавится при +34 °C, кипит при +280 °C. В воде не растворяется, на воздухе легко окисляется и самовоспламеняется. Горит с выделением густого белого дыма — мелких частичек декаоксида тетрафосфора P4O10[1]. Несмотря на то, что в результате реакции между фосфором и водой (4Р + 6Н2О → РН3 + 3Н3РО2) выделяется ядовитый газ фосфин (РН3), для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твердое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания желтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).Жёлтый фосфор.
Слайд 7
Красный фосфор.
Красный фосфор, также называемый фиолетовым фосфором, —
это более термодинамически стабильная модификация элементарного фосфора. Впервые он
был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.Красный фосфор имеет формулу (Р4)n и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления красного фосфора, имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа).
Слайд 8 На воздухе красный фосфор воспламеняется при высоких температурах
(при переходе в белую форму во время возгонки), и
у него полностью отсутствует явление хемолюминесценции. Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек. Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.Красный фосфор.
Слайд 9
Чёрный фосфор.
Чёрный фосфор — это наиболее стабильная термодинамически
и химически наименее активная форма элементарного фосфора. Впервые чёрный
фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2·109 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Удивительным свойством чёрного фосфора является его способность проводить электрический ток и свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 18·105 Па.
Слайд 10
Металлический фосфор.
При 8,3·1010 Па чёрный фосфор переходит в
новую, ещё более плотную и инертную металлическую фазу с
плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25·1011 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Слайд 11
Взаимодействие с простыми веществами.
Фосфор легко окисляется кислородом:
4P +
5O2 → 2P2O5,
4P + 3O2 → 2P2O3.
Взаимодействует
со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:с металлами — окислитель, образует фосфиды:
2P + 3Ca → Ca3P2.
2P + 3Mg → Mg3P2.
с неметаллами — восстановитель:
2P + 3S → P2S3,
2P + 3Cl2 → 2PCl3.
Не взаимодействует с водородом.