- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
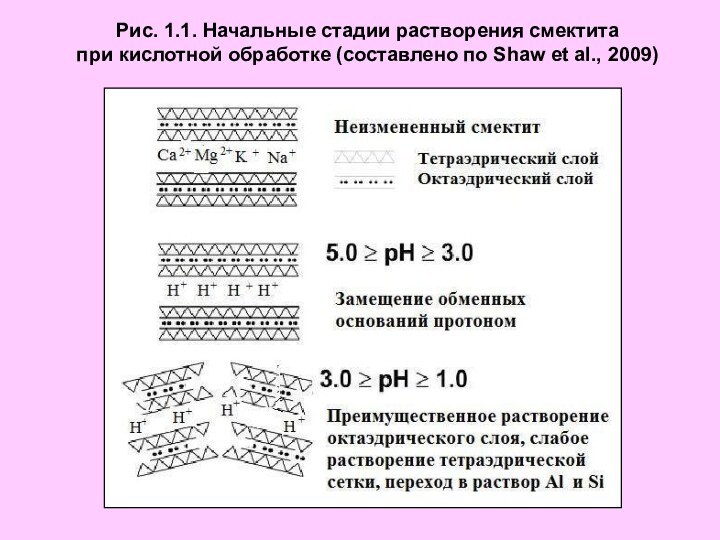
Презентация на тему Начальные стадии растворения смектита при кислотной обработке
Содержание
- 2. Рис. 1.2. Изменение химического состава бентонита в
- 3. Рис. 1.3. Рентген-дифрактограмма бентонита до и после обработки кислотой разной концентрации(составлено по Vucović et al., 2006)
- 4. Рис. 1.5. Схема процесса интеркаляции и вытеснения
- 5. Рис. 1.6. Способная к формированию сильной водородной
- 6. Рис. 1.7. Различные типы взаимодействий смектитов с органическими молекулами (составлено по Lagaly et al., 2006)
- 7. Ионы, используемые для получения органо-глиндецил-аммонийные
- 8. Рис. 1.7.а. Расположение алкиламмонийных ионов в межпакетных
- 9. Рис. 1.8. Влияние величины заряда и длины
- 10. Рис. 1.9. Расположение и упаковка ионов додециламмония
- 11. Табл. 1.1. Сорбция четвертичных аминов с разной
- 12. Рис. 1.10. Удельная поверхности, рассчитанная по уравнению
- 13. Na-монтмориллонит Органо-монтмориллонитРис. 1.11.
- 14. Гидролиз и полимеризация соединений алюминия(AlOH)2+ + H2O
- 15. Рис. 1.12. Схематическое изображение структуры «Кеггин-иона»Al13O4(OH)24(H2O)1277+ (частицы Al13) (составлено по Bertsch, Parker, 1996) AlIVO4AlVI12(OH)24(H2O)1277+
- 16. Рис. 1.13. Лабильный трехслойный глинистый минерал с
- 17. Табл. 1.2. Базальные межплоскостные расстояния исходного и
- 18. Табл. 1.3. Объем порового пространства (общий, микро-
- 19. Табл. 1.4. Удельная поверхность (общая, микро- и
- 20. Табл. 1.5. Значения базальных межплоскостных расстояний ГМИКС,
- 21. Термическая стабильность и другие характеристики Al-модифицированного монтмориллонитов,
- 22. Рис. 1.14. Рентгенограммы ГМИКС, полученных из монтмориллонита
- 23. Табл. 1.6. Удельная поверхность и объем порового
- 24. Рис. 1.16. Схематическое изображение структуры исходного Na-монтмориллонита
- 25. Рис. 1.17. ИК-спектры монтмориллонитав Na и Са-формах
- 26. Скачать презентацию
- 27. Похожие презентации
Рис. 1.2. Изменение химического состава бентонита в результате обработки кислотой при 900С (составлено по Vucović et al., 2006)




















Слайд 2
Рис. 1.2. Изменение химического состава бентонита
в результате
обработки кислотой при 900С
2006)Слайд 3 Рис. 1.3. Рентген-дифрактограмма бентонита до и после обработки
кислотой разной концентрации
(составлено по Vucović et al., 2006)
Слайд 4
Рис. 1.5. Схема процесса интеркаляции и вытеснения
адсобированных
органических молекул
на 1:1 глинистых минералах
(составлено по Lagaly
et al., 2006)
Слайд 5
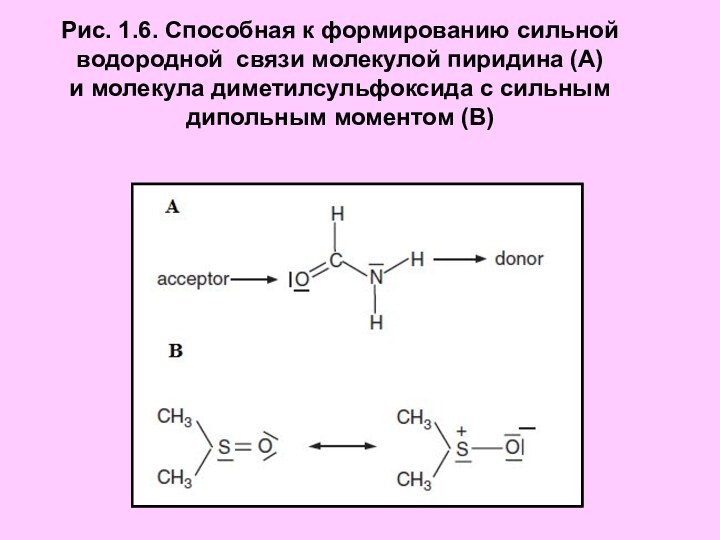
Рис. 1.6. Способная к формированию сильной
водородной связи
молекулой пиридина (А)
и молекула диметилсульфоксида с сильным дипольным
моментом (В)
Слайд 6
Рис. 1.7. Различные типы взаимодействий
смектитов с органическими
молекулами (составлено по Lagaly et al., 2006)
Слайд 7
Ионы, используемые для получения
органо-глин
децил-аммонийные
CH3(CH2)9NH3+ (C10)
додециламмонийные СH3(CH2)11NH3+
(C12)CH3
Ӏ
тетраметиламмоний CH3 - N+ - CH3
Ӏ
CH3
Слайд 8 Рис. 1.7.а. Расположение алкиламмонийных ионов в межпакетных промежуках
смектитов: (a) – монослой, (b) – бимолекулярный слой, (с)
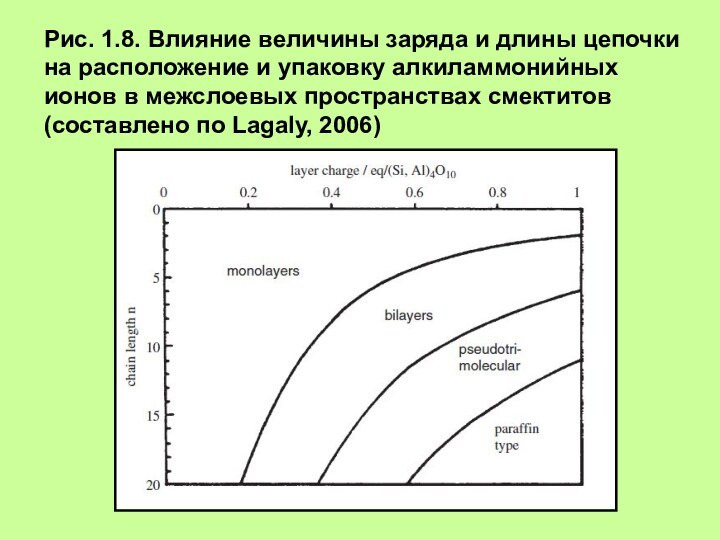
– псевдотримолекулярный слой, (d, e) – парафиноподобная упаковкаСлайд 9 Рис. 1.8. Влияние величины заряда и длины цепочки
на расположение и упаковку алкиламмонийных ионов в межслоевых пространствах
смектитов (составлено по Lagaly, 2006)Слайд 10 Рис. 1.9. Расположение и упаковка ионов додециламмония и
молекул спиртов в межслоевых пространствах смектита: (a) – расположение
молекул спиртов с малым числом атомов С; (b) –бимолекулярная структура с плотной упаковкой алкиламмонийных ионов и молекул и спиртов одинаковой длины; (с) и (d) – наличие вакантных пустот при разной длине алкиламмонийных ионов и молекул спиртов; (е) – уменьшением длины молекул за счет изогнутости (составлено по Lagaly, 2006)Слайд 11 Табл. 1.1. Сорбция четвертичных аминов с разной длиной
цепочки на монтмориллоните в Na- и К-формах, в %
от добавленного количества (составлено по Zhang et al., 1993)НТМА – нонилтриметиламмоний (С9), ДТМА – додецилтриметиламмоний (С 12), ГДТМА – гексадецилтриметиламмоний (С19)
Слайд 12
Рис. 1.10. Удельная поверхности, рассчитанная по уравнению БЭТ,
и объем порового пространства исходного Na-монтмориллонита и органо-монтмориллонита с
разным количеством сорбированного HDTMA (составлено по He at al., 2006)
Слайд 13
Na-монтмориллонит Органо-монтмориллонит
Рис. 1.11. Схематическое
изображение структуры Na-
монтмориллонита и органо-глины (составлено по He et
al., 2006)
Слайд 14
Гидролиз и полимеризация соединений
алюминия
(AlOH)2+ + H2O ↔
(Al(OH)2)+ + (H+)
(Al(OH)2)+ + H2O ↔ (Al(OH)3)0 + (H+)
(Al(OH)3)0
+ H2O ↔ (Al(OH)4)- + (H+)(Al)3+ + H2O ↔ (AlOH)2+ + (H+)
xAl3+ + yH2O = Alx(OH)y(3x – y)+ + yH+
Al2(OH)24+, Al2(OH)5+,
Al3(OH)8+, Al3(OH)45+,
Al6(OH)126+ Al10(OH)228+,
Al13(OH)309+, Al19(OH)4611+
Al13O4(OH)24(H2O)127+
Al2(OH)24+
Al6(OH)126+
Ионный
радиусAl3+
равен 0,05 нм
Общая формула гидроксополимеров Al: [Alx(OH)Y](3x-y)+
1 ≤x ≤54 1 ≤y ≤144
Реакция гидролиза
Слайд 15
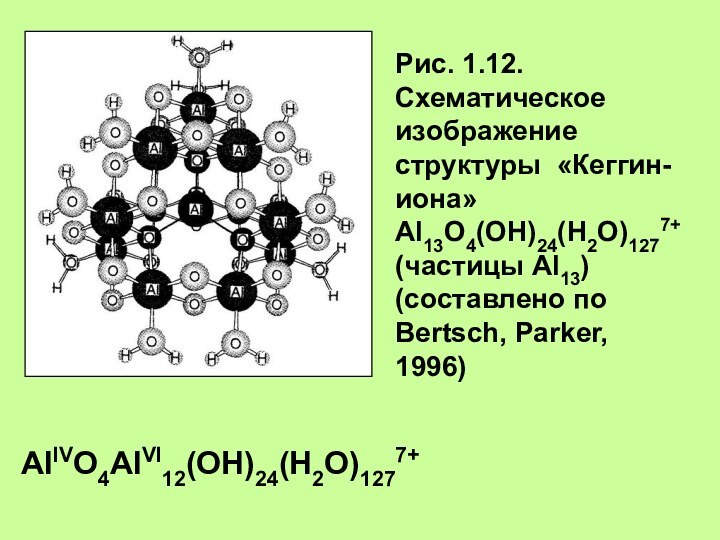
Рис. 1.12. Схематическое изображение структуры «Кеггин-иона»
Al13O4(OH)24(H2O)1277+ (частицы Al13)
(составлено по Bertsch, Parker,
1996)
AlIVO4AlVI12(OH)24(H2O)1277+
Слайд 16 Рис. 1.13. Лабильный трехслойный глинистый минерал с колоннобразными
структурами из Al13 в межпакетном пространстве (составлено по Bergaya
et al., 2006)Слайд 17 Табл. 1.2. Базальные межплоскостные расстояния исходного и интеркалированного
Al-оксополикатионами монтмориллонита, прокаленного при разных температурах после старении системы
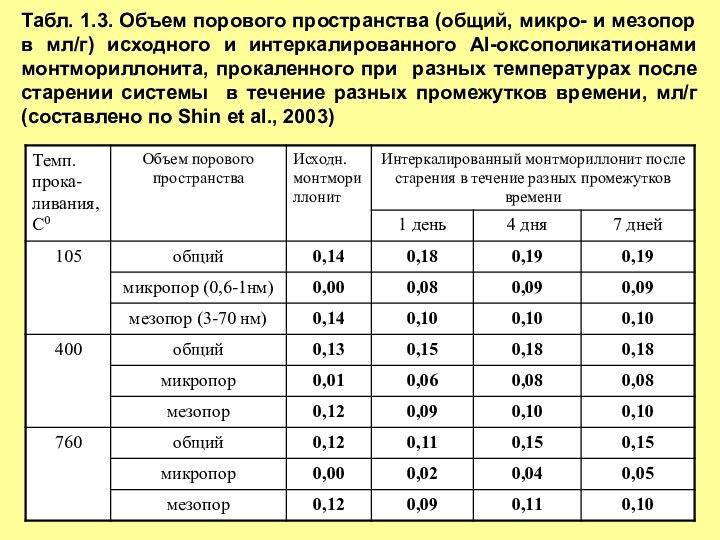
в течение разных промежутков времени (составлено по Shin et al., 2003), нмСлайд 18 Табл. 1.3. Объем порового пространства (общий, микро- и
мезопор в мл/г) исходного и интеркалированного Al-оксополикатионами монтмориллонита, прокаленного
при разных температурах после старении системы в течение разных промежутков времени, мл/г (составлено по Shin et al., 2003)Слайд 19 Табл. 1.4. Удельная поверхность (общая, микро- и мезопор)
исходного и интеркалированного Al-оксополикатионами монтмориллонита, прокаленного при разных температурах
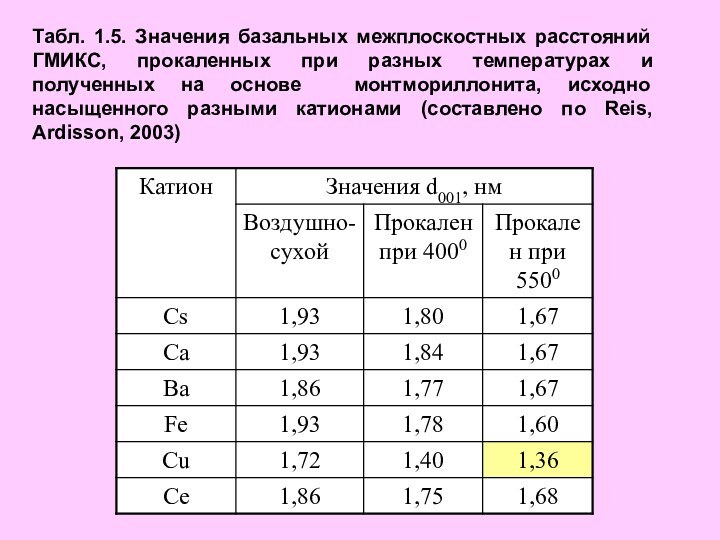
после старении системы в течение разных промежутков времени, м2/г (составлено по Shin et al., 2003)Слайд 20 Табл. 1.5. Значения базальных межплоскостных расстояний ГМИКС, прокаленных
при разных температурах и полученных на основе монтмориллонита, исходно
насыщенного разными катионами (составлено по Reis, Ardisson, 2003)Слайд 21 Термическая стабильность и другие характеристики Al-модифицированного монтмориллонитов, зависит
также от состава катионов, исходно насыщающих минерал. Как видно
из табл. 1.5, монтмориллонит, насыщенный Cs, Ca, Ba, Fe, и Ce после прокаливания при 5500С имели близкие значения межплоскостного расстояния 1,60-1,68 нм.Структура, образованная по Cu-монтмориллониту, оказалась менее термостабильной и имела значение d001, равное 1,36 нм (Reis, Ardisson, 2003). Из всех перечисленных катионов только Cu может закрепляться в гексагональных пустотах тетраэдрических сеток, что способствует протеканию реакции дегидроксилации, и, следовательно, сжатию кристаллической решетки.
Слайд 22
Рис. 1.14.
Рентгенограммы
ГМИКС, полученных
из монтмориллонита
и
солей Al с разным
составом анионов:
Al-хлорид (a),
Al-сульфат (b),
Al-нитрат (с),
Al-хлоридрол (d)
(составлено по
Aouad et.al., 2006)
Хлоргидрол –
Al2(OH)5Cl 2H2O
Слайд 23 Табл. 1.6. Удельная поверхность и объем порового пространства
ГМИКС, полученного при взаимодействии монтмориллонита с солями Al с
разным составом анионов (составлено по Aouad et al, 2006)Слайд 24 Рис. 1.16. Схематическое изображение структуры исходного Na-монтмориллонита и
модифицированной структуры в виде «карточного домика» (составлено по Yuan
et.al., 2006)
Слайд 25
Рис. 1.17.
ИК-спектры
монтмориллонита
в Na и Са-формах
до (A, B) и после
(C, D, H, I,
J, K) взаимодействия
с продуктами
гидролиза
и полимеризации
Fe с разными мольными
отношениями ОH:Fe
в исходном
растворе
В порах закрепляется некоторое количество NO3- (полоса поглощения 1384 см-)