- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Ученический проект Шпаргалки по теме Подгруппа азота. Общая характеристика
Содержание
- 2. Общая характеристика подгруппы
- 3. Азот(N2)Азо́т — элемент 15-й группы (по устаревшей классификации — главной подгруппы
- 4. Простое вещество При обычных условиях газ без цвета и запаха,
- 5. Жидкий азот
- 6. Фосфор(Р)Фо́сфор — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы
- 7. Простое веществоЭлементарный фосфор при нормальных условиях существует в виде
- 8. Аллотропия фосфораБелый фосфорБелый фосфор представляет собой белое
- 9. Красный фосфорКрасный фосфор — это более термодинамически стабильная
- 10. Чёрный фосфорЧёрный фосфор — это наиболее стабильная термодинамически
- 12. Мышьяк(As)Мышья́к — химический элемент 15-й группы (по устаревшей классификации —
- 13. Простое веществоВ свободном состоянии мышьяк похож на
- 15. Сурьма(Sb)Сурьма́ - химический элемент 15-й группы (по устаревшей классификации — главной
- 16. Простое веществоВ свободном состоянии сурьма образует серебристо-белые
- 18. Висмут(Bi)Ви́смут — химический элемент 15-й группы (по устаревшей классификации — главной
- 19. Простое веществоВисмут — металл серебристо-белого цвета с розоватым оттенком. Известно
- 20. Скачать презентацию
- 21. Похожие презентации
Общая характеристика подгруппы

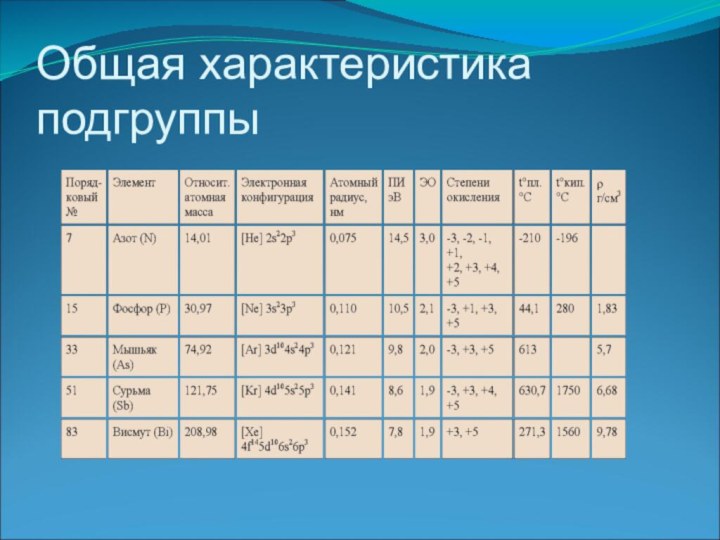


















Слайд 4
Простое вещество
При обычных условиях газ без цвета и запаха, встречается
в свободном состоянии в воздухе (78% по объему) и
в связанном состоянии в составе природных нитратов. В молекуле азота связь тройная, состоящая из одной σ-связи и двух π-связей. Поэтому химическая связь в молекуле азота прочная, энергия диссоциации велика, и он с трудом вступает в химические реакции.
Слайд 6
Фосфор(Р)
Фо́сфор — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой
группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Фосфор
— один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3(F,Cl,OH),фосфорит и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Слайд 7
Простое вещество
Элементарный фосфор при нормальных условиях существует в виде нескольких
устойчивых аллотропических модификаций. Все возможные аллотропические модификации фосфора пока (2014 г.)
до конца не изучены. Традиционно различают четыре его модификации: белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные описываемые модификации являются смесью этих четырёх. При стандартных условиях устойчивы только три аллотропических модификации фосфора (например, белый фосфор термодинамически неустойчив (квазистационарное состояние) и переходит со временем при нормальных условиях в красный фосфор). В условиях сверхвысоких давлений термодинамически устойчива металлическая форма элемента. Все модификации различаются по цвету, плотности и другим физическим и химическим характеристикам, особо, по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный (металлический).
Слайд 8
Аллотропия фосфора
Белый фосфор
Белый фосфор представляет собой белое вещество
(из-за примесей может иметь желтоватый оттенок). По внешнему виду он
очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.Белый фосфор имеет молекулярную кристаллическую решётку, формула молекулы белого фосфора — P4, причём атомы расположены в вершинах тетраэдра. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах.
Плохо растворяется в воде, но легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). При взаимодействии с кислородом белый фосфор горит даже под водой.
Белый фосфор не только активен химически, но и весьма ядовит: летальная доза белого фосфора для взрослого человека составляет 0,05—0,15 г, а при хроническом отравлении поражает кости, например, вызывает омертвение челюстей. При контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги.
Под действием света, при нагревании до не очень высоких температур в безвоздушной среде, а также под действием ионизирующего излучения белый фосфор превращается в красный фосфор.
Жёлтый фосфор
Неочищенный белый фосфор обычно называют «жёлтый фосфор». Сильно ядовитое, огнеопасное кристаллическое вещество от светло-жёлтого до тёмно-бурого цвета. Удельный вес 1,83 г/см³, плавится при +43,1 °C, кипит при +280 °C. В воде не растворяется, на воздухе легко окисляется и самовоспламеняется. Горит ослепительным ярко-зеленым пламенем с выделением густого белого дыма — мелких частичек декаоксида тетрафосфора P4O10.
Так как фосфор реагирует с водой лишь при температуре свыше 500 градусов по цельсию, то для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твердое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).
Слайд 9
Красный фосфор
Красный фосфор — это более термодинамически стабильная модификация
элементарного фосфора. Впервые он был получен в 1847 году в Швеции
австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах, чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа). Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Слайд 10
Чёрный фосфор
Чёрный фосфор — это наиболее стабильная термодинамически и
химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор
был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2·109 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 18·105 Па.
Металлический фосфор
При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25·1011 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Слайд 12
Мышьяк(As)
Мышья́к — химический элемент 15-й группы (по устаревшей классификации — главной
подгруппы пятой группы) четвёртого периода периодической системы; имеет атомный номер 33. Простое
вещество представляет собой хрупкий полуметалл стального цвета с зеленоватым оттенком (в серой аллотропной модификации). CAS-номер: 7440.
Слайд 13
Простое вещество
В свободном состоянии мышьяк похож на металл,
он довольно хорошо проводит электрический ток и тепло, однако,
в отличие от настоящих металлов, он очень хрупок и легко измельчается в ступке в порошок. Мышьяк способен существовать в нескольких аллотропических формах, из которых наиболее устойчив серый, так называемый металлический. С повышением давления ее температура плавления довольно быстро возрастает (достигая 950оС при 60 тыс. ат). При очень быстрой конденсации паров мышьяка на поверхности, охлаждаемой жидким азотом, получаются прозрачные, мягкие как воск кристаллы желтого мышьяка (решетка кубическая) с плотностью 2,0 г/см3, довольно хорошо растворимый в сероуглероде (около 8% при 20оС) и образующий при упаривании такого раствора желтые кристаллы. Последние слагаются из молекул As4, имеющих структуру правильного тетраэдра. На воздухе желтый мышьяк легко окисляется, а под действием света быстро переходит в серую форму. При возгонке As в струе водорода образуется аморфный черный мышьяк с плотностью 4,7 г/см3. Последний не окисляется на воздухе, но выше 270оС переходит в серую форму (теплота перехода 1 ккал/г-атом). Компактный (плавленый) серый мышьяк имеет вид серебристого крупнокристаллического металла. Серый мышьяк очень хрупок; твердость по Бринеллю 1500 МПа, твердость по Моосу 3,5. Мышьяк диамагнитен, магнитная восприимчивость – 5,5*10-6; обладает металлической проводимостью; ρ 3,3*10-5 Ом*см, температурный коэффициент ρ 3,9*10-3 К-1 (273-373 К).
Слайд 15
Сурьма(Sb)
Сурьма́ - химический элемент 15-й группы (по устаревшей классификации — главной подгруппы
пятой группы) пятого периода периодической системы химических элементов Д. И. Менделеева; имеет атомный
номер 51. Простое вещество сурьма (CAS-номер: 7440-36-0) — полуметалл серебристо-белого цвета с синеватым оттенком, грубозернистого строения. Известны четыре металлических аллотропных модификаций сурьмы, существующих при различных давлениях, и три аморфные модификации (взрывчатая, чёрная и жёлтая сурьма).
Слайд 16
Простое вещество
В свободном состоянии сурьма образует серебристо-белые кристаллы,
обладающие металлическим блеском и имеющие плотность 6,68 г/см3. Напоминая
по внешнему виду металл, кристаллическая сурьма отличается хрупкостью и значительно хуже проводит тепло и электрический ток, чем обычные металлы. Кроме кристаллической сурьмы, известны и другие ее аллотропические видоизменения. Сурьма хрупка, легко раскалывается по плоскостям спайности, истирается в порошок и не поддается ковке. Сурьма относится к разряду «полуметаллов», потому что по внешнему виду сурьма-типичный металл (серо-белый цвет с легким синеватым оттенком), но, в отличие от большинства металлов, она, во-первых, очень хрупка и легко истирается в порошок, а во-вторых, значительно хуже проводит электричество и тепло. Сурьма известна в кристаллической и трех аморфных формах (взрывчатая, черная и желтая). Взрывчатая Сурьма взрывается при любом соприкосновении; черная- при быстром охлаждении паров Сурьмы; желтая - при пропускании кислорода в сжиженный SbH 3. Желтая и черная Сурьма неустойчивы, при пониженных температурах переходят в обыкновенную Сурьму.
Слайд 18
Висмут(Bi)
Ви́смут — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы
пятой группы) шестого периода периодической системы химических элементов Д. И. Менделеева; имеет атомный номер 83.
Простое вещество представляет собой при нормальных условиях блестящий серебристый с розоватым оттенком металл.
Слайд 19
Простое вещество
Висмут — металл серебристо-белого цвета с розоватым оттенком. Известно большое
количество аллотропных модификаций висмута, которые имеют место при высоком
давлении. Существует восемь кристаллографических модификаций висмута. При давлении 2,57 ГПа и температуре 25 °C кристаллическая решётка висмута претерпевает полиморфное превращение из ромбоэдрической в моноклинную с параметрами решётки a = 0,6674 нм, b = 0,6117 нм, c = 0,3304 нм, β = 110,33°, пространственная группа C2m. При давлениях 2,72 ГПа, 4,31 ГПа и около 5 ГПа также происходят полиморфные превращения кристаллической решётки висмута. При давлении 7,74 ГПа висмут имеет кубическую решётку, пространственная группаIm3m с параметром решётки a = 0,3800 нм. В интервале давлений 2,3—5,2 ГПа и температур 500—580 °C висмут имеет тетрагональную решетку с параметрами a = 0,657 нм, c = 0,568 нм. При давлении 30 ГПа также обнаружено полиморфное превращение.Переход висмута из твёрдого в жидкое состояние сопровождается увеличением плотности с 9,8 г/см3 до 10,07 г/см3, которая постепенно уменьшается с повышением температуры и при 900 °C составляет 9,2 г/см3. Обратный переход висмута из жидкого в твёрдое состояние сопровождается увеличением объёма на 3,3 %. Повышение плотности при плавлении наблюдается лишь у немногих веществ; другим хорошо известным примером вещества с таким свойством является вода.
Удельное электрическое сопротивление висмута равно 1,2 мкОм·м при 17,5 °C и повышается с ростом температуры. Интересной особенностью является то, что удельное сопротивление при плавлении уменьшается: у твёрдого висмута (при 269 °C) оно составляет 2,67 мкОм·м, а в жидком состоянии (при 272 °C) — лишь 1,27 мкОм·м.
Температурный коэффициент линейного расширения равен 13,4·10−6 К−1 при 293 К (20 °C).
По сравнению с другими металлами висмут, как и ртуть, обладает низкой теплопроводностью, равной 7,87 Вт/(м·К) при 300 К.
Висмут является диамагнетиком с магнитной восприимчивостью −1,34·10−9 при 293 K, что делает его самым диамагнитным металлом. Образец висмута, подвешенный на нитке, достаточно заметно отклоняется в сторону от поднесенного сильного магнита.
Переходит в сверхпроводящее состояние при температуре 7 К.
При комнатной температуре висмут хрупкий металл и в изломе имеет грубозернистое строение, но при температуре 150—250 °C проявляет пластические свойства. Монокристаллы висмута пластичны и при комнатной температуре, и при медленном приложении усилия легко изгибаются. При этом можно ощутить «ступенчатость» процесса и даже услышать легкий хруст — это связано с двойникованием, за счёт которого упругое напряжение скачком снимается.




























