- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Атом - сложная частица. (11 класс)
Содержание
- 2. «Всё окружающеенас состоит из неделимых частиц(около 460
- 4. Вильгельм Конрад Рентген немецкий физик(1845-1923)В 1895 году
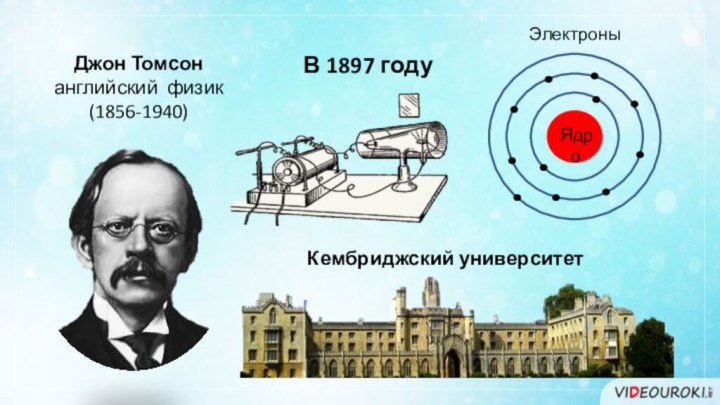
- 5. Джон Томсонанглийский физик(1856-1940)В 1897 годуЭлектроны
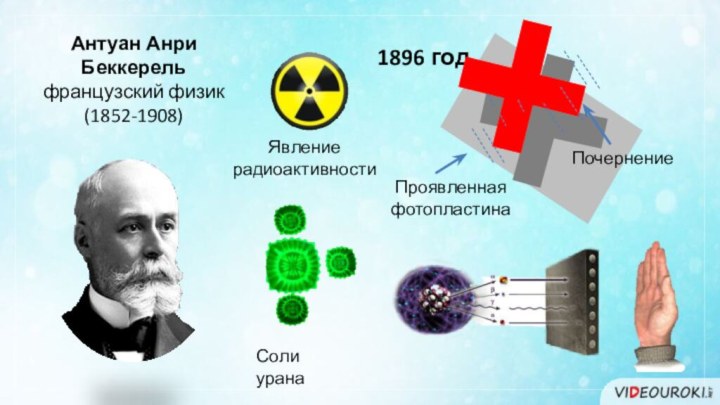
- 6. 1896 годАнтуан Анри Беккерельфранцузский физик(1852-1908)
- 7. В 1903 году Мария Склодовская-Кюрипольская физик-химик(1867-1934)Открытие радияПьер Кюри французский физик-химик(1859-1906)Открытие полония
- 8. Джон Томсонанглийский физик(1856-1940)«Пудинговая модель»В 1904 году Электроны
- 9. Эрнест Резерфорданглийский физик(1871-1937)В 1907 году «Планетарная модель»?
- 10. Электроны передвигаются по замкнутым орбитам в соответствии
- 11. В 1932 году Дмитрий Дмитриевич Иваненкорусский физик(1904–1994)
- 12. – это разновидности атомов химических элементов, которые
- 13. ₁₅PФосфорZ = 15Протонов е⁻= 15ЭлектроновМассовое число
- 14. Изменение числа протонов в атоме приводит к
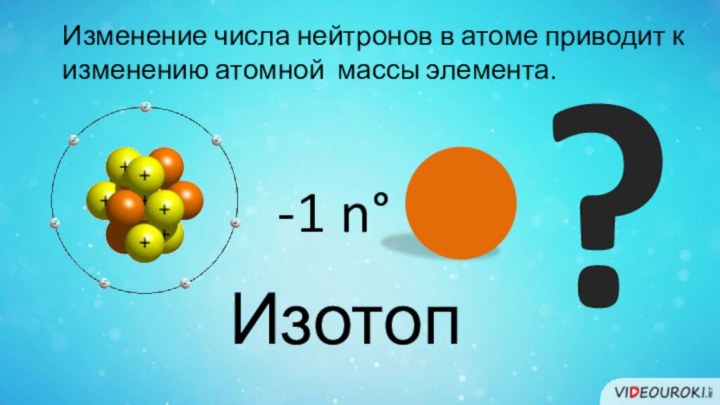
- 15. Изменение числа нейтронов в атоме приводит к изменению атомной массы элемента. -1 n°?Изотоп
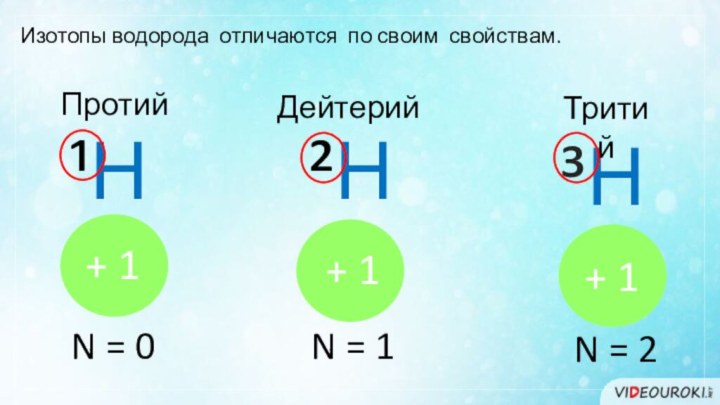
- 16. Изотопы водорода отличаются по своим свойствам. ³Н ²Н ¹НПротийДейтерийТритийN = 0N = 1N = 2
- 17. Химический элемент – это совокупность атомов с одинаковым зарядом ядра. ₇NАзот+ 7 ₈ОКислород+ 8 ₉FФтор+ 9
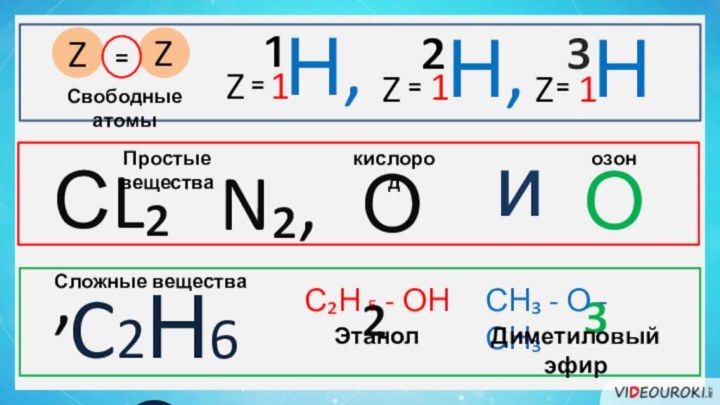
- 18. ¹Н, ²Н, ³Н
- 19. Скачать презентацию
- 20. Похожие презентации
«Всё окружающеенас состоит из неделимых частиц(около 460 до н. э. — около 360 до н. э.)или атомов»











Слайд 7
В 1903 году
Мария Склодовская-Кюри
польская физик-химик
(1867-1934)
Открытие радия
Пьер Кюри
французский физик-химик
(1859-1906)
Открытие
полония
Слайд 8
Джон Томсон
английский физик
(1856-1940)
«Пудинговая модель»
В 1904 году
Электроны совершают
колебательные движения, благодаря которым атом испускает электромагнитную энергию, а
сам атом – электронейтрален.Слайд 10 Электроны передвигаются по замкнутым орбитам в соответствии значения
своей энергии, которая не выделяется и не поглощается при
этом.Электрон может переходить из одного в другое разрешённое энергетическое состояние, испуская или поглощая при этом энергию.
В 1913 году
Нильс Бор
датский физик
(1885-1962)
Квантовая теория
Слайд 11
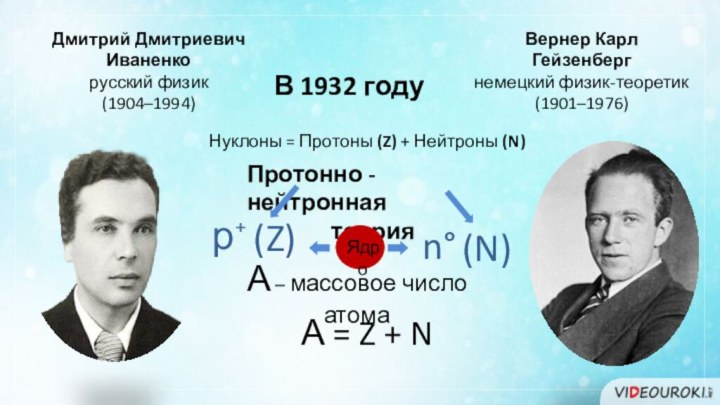
В 1932 году
Дмитрий Дмитриевич
Иваненко
русский физик
(1904–1994)
Вернер
Карл
Гейзенберг
немецкий физик-теоретик
(1901–1976)
Протонно - нейтронная
теория
Нуклоны = Протоны
(Z) + Нейтроны (N)А – массовое число атома
= Z + N
р⁺
n°
А
(Z)
(N)
Слайд 12
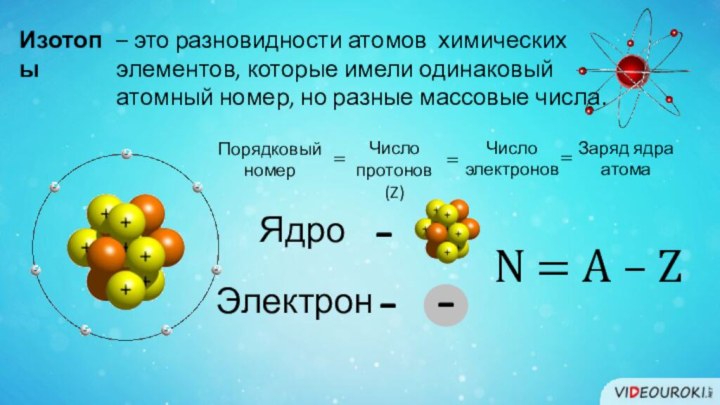
– это разновидности атомов химических
элементов, которые имели
одинаковый
атомный номер, но разные массовые числа.
Число протонов (Z)
Число электронов
Заряд ядра
атома
Порядковый номер
N = А – Z
=
=
=
Ядро
-
-
Электрон
Изотопы
Слайд 14 Изменение числа протонов в атоме приводит к образованию
нового химического элемента, потому что изменяется заряд ядра атома.
+
1 протон (Z)+ 1 протон (Z)





























