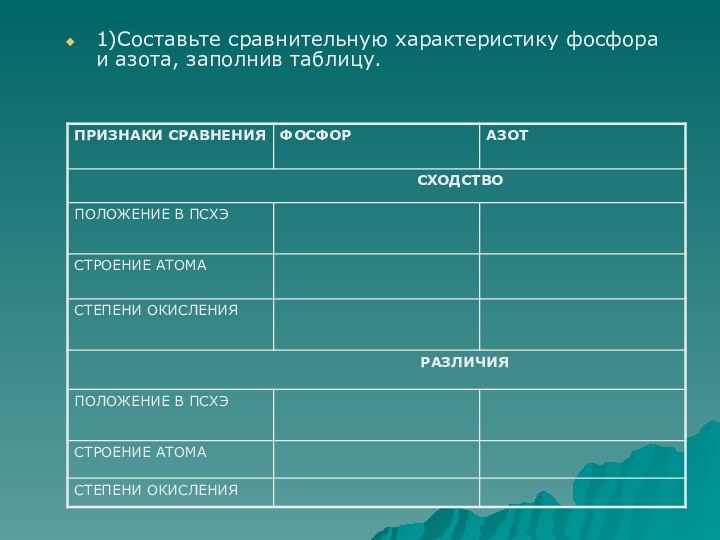
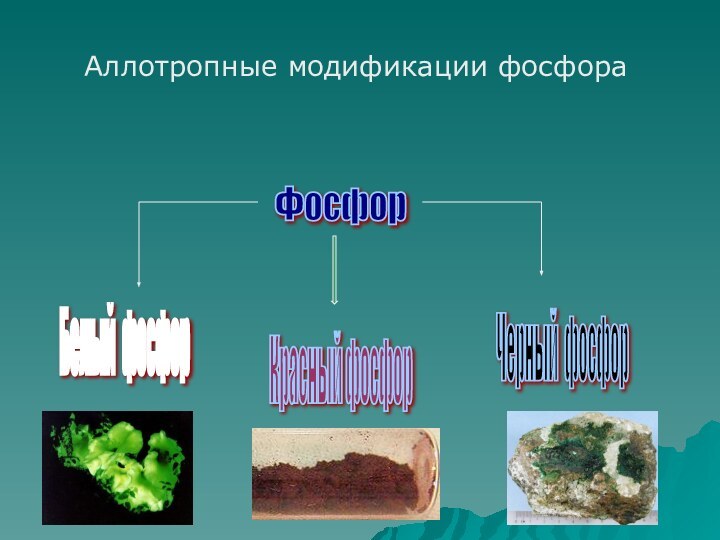
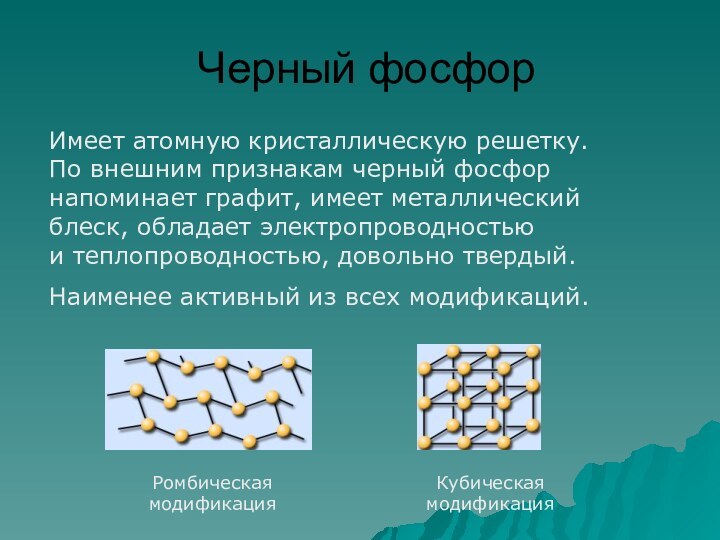
фосфор имеет молекулярную решетку, в узлах которой находятся тетраэдрические
молекулы Р4.
Это очень реакционноспособное, мягкое воскообразное вещество бледно-желтого цвета, с неприятным чесночным запахом, растворимое в сероуглероде и бензоле,
нерастворимое в воде. Очень ядовит. Воспламеняется при трении, обладает уникальной способностью светиться в темноте за счет медленного окисления.
Температура плавления – 44оС. В лаборатории его хранят под слоем воды. Смертельная доза– 0,1 г.При нагревании без доступа воздуха до 250-300 градусов белый фосфор превращается в красный.