Слайд 2
Определение и этимология галогенов
Галоге́ны (от греч.
ἁλός — «соль» и γένος — «рождение, происхождение»;) —
химические элементы 7-ой группы периодической таблицы химических элементов Д. И. Менделеева (по устаревшей классификации — элементы главной подгруппы VII группы).
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент унунсептий Uus.
Термин «галогены» в отношении всей группы элементов был предложен в 1841 году шведским химиком Й. Берцелиусом. Первоначально слово «галоген» (в буквальном переводе с греческого — «солерод») было предложено в 1811 году немецким учёным И. Швейггером в качестве названия для недавно открытого хлора, однако в химии закрепилось название, которое предложил Г. Дэви.
Слайд 3
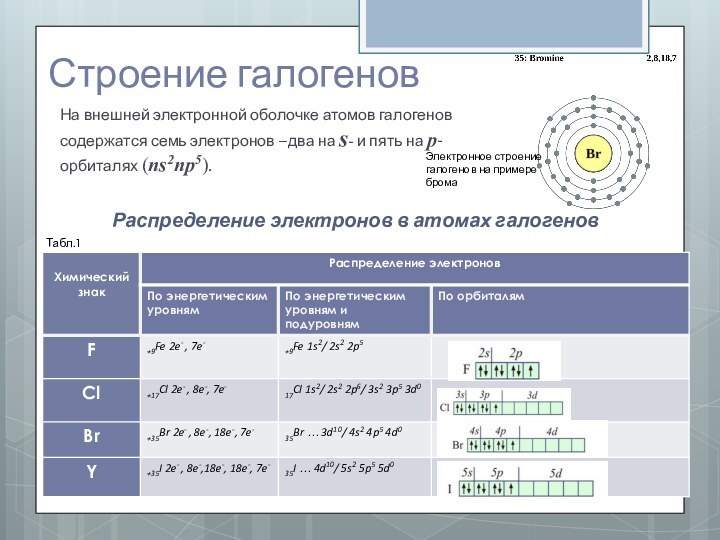
Строение галогенов
На внешней электронной оболочке атомов галогенов
содержатся семь электронов –два на s- и пять на
p-орбиталях (ns2np5).
Электронное строение галогенов на примере брома
Табл.1
Распределение электронов в атомах галогенов
Слайд 4
Свойства атомов
Увеличивается радиус атома
Неметаллические свойства ослабевают
Уменьшается окислительная способность
С увеличением относительной молекулярной массы веществ увеличивается температура кипения
и температура плавления. Все простые вещества – галогены имеют молекулярную кристаллическую решётку, которая оказывает влияние на агрегатное состояние молекул, поэтому фтор и хлор -газы, бром – жидкость, а йод – твёрдое вещество, но для йода характерно такое физическое явление как возгонка, т.е.переход вещества из твердого состояния в газообразное, минуя жидкую фазу. При возгонке в нагреваемой части прибора кристаллическое вещество испаряется, а в охлажденной снова конденсируется.
Слайд 7
Получение галогенов
В свободном состоянии
галогены в природе не встречаются. Обычно они встречаются в
восстановленном состоянии, а йод даже в окисленном в виде йодатов.
Фтор можно получить электролизом расплавов его фторидов . Либо по реакции К.Кристе:
Бром и йод можно получить взаимодействием бромидов, йодидов с окислителями.
Для получения йода из йодатов на них действуют восстановителями.
2NaIO3+5SO2+4H2O=2NaHSO4↓+I2↓+3H2SO4
Слайд 9
Окислительно-восстановительные свойства
Об уменьшении окислительных и увеличении восстановительных свойств
галогенов от фтора к иоду можно судить и по
их способности вытеснять друг друга из растворов солей.
Сl2 + 2NaBr(pp) = 2NaCl(p.p) + Br2
Ослабление окислительных свойств галогенов от фтора к иоду наглядно проявляется при взаимодействии их с водородом.
Н2 + Г2 = 2НГ (в любых условиях со взрывом)
H2 + Cl2 = 2HCl (при поджигании или облучении прямым солнечным светом)
H2 + Br2 = 2HBr (при нагревании и без взрыва)
H2 + I2 = 2HI (протекает медленно даже при нагревании)
Слайд 11
Минералы
Карналлит
Каменная соль = поваренная соль = галит
Сильвин
Слайд 12
Получение
Основной промышленный способ получения хлора – электролиз хлоридов
щелочных металлов (NaCl, KCl). Также его получают окислением HCl
кислородом воздуха в присутствии катализаторов – хлорида меди (II) и хлорида железа (III):
4HCl + O2 = 2Cl2 + 2H2O
В лаборатории молекулярный хлор получают взаимодействием HCl с перманганатом калия, оксидом марганца (IV), бихроматом калия и др.:
2KMnO4+16HCl (конц.) = 2KCl+2MnCl2+8H2O+5Cl
При нагревании:
MnO2 + 4 HCl = MnCl2 + Cl2 + 2 H2O
2KMnO4+16HCl (конц.)= 2KCl + 2MnCl2 + 8H2O + 5Cl2
Слайд 13
Химические свойства
Хлор – активный окислитель. Энергично реагирует с металлами
и большинством неметаллов (за исключением O2, N2 и благородных
газов). Вступает также в реакции диспропорционирования, для протекания которых наиболее благоприятна щелочная среда, способствующая образованию простых и сложных анионов.
Слайд 14
Хлор - один из самых активных неметаллов. При
взаимодействии с металлами с переменной валентностью (Fe, Cr) в
отличие от соляной кислоты заставляет их проявлять большую степень окисления:
С Металлами
2Al + 3Cl2 = 2AlCl3
2K + Cl2 = 2 КCl
2 Fe + 3Cl2 = 2 FeCl3
Cu + Cl2 = CuCl2
Слайд 15
С неМеталлами
H2 + Cl2 = 2 HCl(на свету)
2Cl2 + C = CCl4
3Cl2 + 2P (крист.) =
2PCl3
5 Cl2 + 2 P = 2PCl5
Образует соединения с другими галогенами:
Cl2 + F2 = 2ClF
Cl2 + 3F2 = 2ClF3, t = 200–400 °C
Cl2 + 5F2 = 2ClF5
Слайд 16
С бескислородным кислотами
Cl2 + HBr = 2HCl +
Br2
Cl2 + HI = 2HCl + I2
С Солями
Cl2 +
2NaI = 2NaCl + I2
Cl2 + FeCl2 = 2FeCl3
Слайд 17
Хлор в органике
Хлор является активным реагентом в органическом
синтезе. Его атомы входят в состав молекул соединений, относящихся
к различным классам органических веществ.
1.CnH2n+2 + Cl2 (на свету) = CnH2n+1Cl + HCl [р. Семенова]
2. CnH2n + Cl2 = CnH2nCl2
3. CnH2n-2 + Cl2 – в несколько стадий
4. C6H6 + Cl2 (AlCl3) = C6H5Cl + HCl
5 .C6H6 + Cl2 (на свету) = гексахлоран
Гомологи бензола + Cl2 (на свету) = замещение
по радикальному механизму (Cl к альфа-H)
6.R-CH2-COOH + Cl2 (PCl5) = R-CHCl-COOH + HCl
Слайд 18
Применение хлора
Хлор применяют во многих
отраслях промышленности, науки и бытовых нужд:
Основным компонентом отбеливателей
является хлорная вода
В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы.
Слайд 19
Для обеззараживания воды — «хлорирования».
В химическом
производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов,
ядов, лекарств, удобрений.
Слайд 20
Опыт 1.
Демонстрирует способы получения хлора и его физические
свойства.
а) Взаимодействие соляной кислоты с
оксидом марганца (4).
В колбе Вюрца с газоотводной трубкой насыпаем немного MnO2 , вливаем концентрированную солянку и нагреваем:
MnO2 + 4HCl = Cl2 + MnCl2 + 2H2O
Слайд 21
б)Взаимодействие концентрированной соляной кислоты с перманганатом калия и
получение хлорной воды.
Колбу Вюрца закрепляем в штативе, насыпаем
перманганат калия и ставим гидравлический затвор, закрываем колбу пробкой с капельной воронкой, в которую на 2/3 наливаем HCl. Газоотводную трубку опустить в наклонненно-закрепленую колбу приемник, заполненную дистиллированной водой. Открываем кран капельной воронки и наблюдаем образование хлорной воды.
Cl2 + H2O = HCl + HClO
2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
Слайд 22
Опыт 2.
Демонстрирует химические свойства хлора при взаимодействии с
простыми веществами.
а) Горение водорода в
хлоре.
В стеклянный цилиндр, заполненный хлором, через аппарат Киппа с длинной изогнутой газоотводной трубкой подаем водород, открыв кран аппарата, поджигаем водород и медленно опускаем трубку с горящим водородом в цилиндр с хлором. Затем налить лакмус в цилиндр. Наблюдаем изменение цвета лакмуса с темно-синего на красный.
H2 + Cl2 = 2HCl
Слайд 23
б) Взрыв смеси хлора с водородом.
Один стеклянный цилиндр наполнить водородом, а
другую – хлором. Закрыть
оба цилиндра стеклянными
пластинками. В помещении должен быть
рассеянный свет. Цилиндр с водородом, не
переворачивая, поставить на цилиндр с хлором.
Быстро убрать стеклянные пластинки и несколько раз
перемешать газы. Разъединить цилиндры. Один из них
быстро обернуть полотенцем и, держа наклонено
отверстием вниз, поднести к пламени горелки.
Прилить в цилиндр раствор лакмуса, видя изменение
раствора с темно-синего цвета до красного.
Cl2 + hv = 2Cl-
H2 + Cl- = HCl + H+
H+ + Cl2 = HCl + Cl-