- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Электрохимический ряд напряжения металлов (9класс)
Содержание
- 2. Электрохимический ряд напряжения металлов. Активность металлов9 класс
- 3. Цели изучения, которым способствует данный урокУмение сравнивать
- 4. Языковая цельУчащиеся могут:• Правильно использовать химические термины, понимать
- 5. Ожидаемый результатОбъяснить понятие - электрохимический ряд напряжения
- 6. Оценивание.Устное поощрение выполненной работы;Самооценивание и взаимооценивание по
- 7. Здравствуйте ребята!Я желаю вам хорошего настроения и плодотворной работы на нашем уроке.
- 8. Предлагает детям разделиться на группы
- 9. Деление на группыПеред вами на столе лежат
- 10. Викторина «Верные – неверные утверждения»Заполните таблицу, вписав ответы ДА или НЕТ
- 11. 1. Металлы занимают верхний левый угол в ПСХЭ.2. В
- 12. Я уверена, вы справились с этим заданием.
- 13. Самопроверка по ключу Викторина «Верные – неверные утверждения»Каждый правильный ответ оценивается в 1 балл
- 14. МОЛОДЦЫ!Тема урока: Электрохимический ряд напряжения металлов. Активность металлов.
- 15. Ca + HCl =Mg + HCl =
- 16. Внимание!!!За каждое правильное уравнение реакции -1 баллВзаимопроверка работ по часовой стрелке
- 17. Ca + 2HCl = CaCl2 + H2↑Mg
- 18. Хвоаьчтсзё!унhttp://aida.ucoz.ru
- 19. (1827-1911)-академик. Предложил и обосновал вытеснительный ряд металловУчитывая
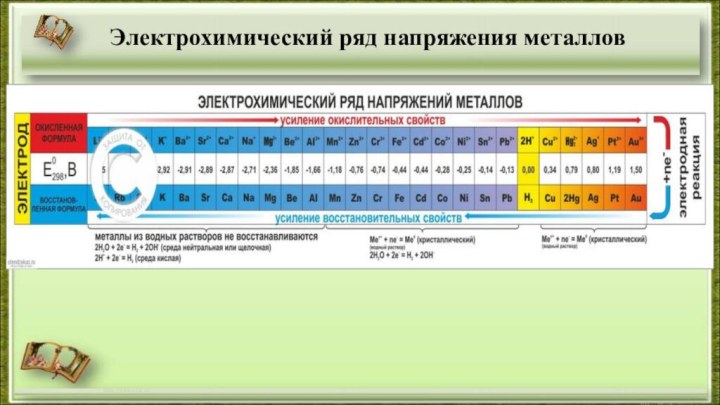
- 20. http://aida.ucoz.ruЭлектрохимический ряд напряжения металлов
- 22. Работа в группах ИНСЕРТ Стр. 142-143Группа №1,
- 23. Работа в группах- ИНСЕРТАктивность металлов калий и
- 24. Внимание!!!Команды оценивают друг друга. Продуктом вашей работы должны быть правила расположения металлов в ЭХРНМДжигсо
- 25. CuSO4CuПринципы расположения металлов в ЭХРНМ1. Уменьшаются восстановительные
- 26. Лабораторный опыт- Группа №1, 3, 5AgРабота с
- 27. Работа с GLX ExplorerНалейте в 4 градуированные
- 28. Работа с GLX ExplorerРабота с GLX.V →
- 29. Итог работы:Составьте свой вытеснительный ряд металлов. Расположите
- 30. МОЛОДЦЫ РЕБЯТА!ЗАЩИТА РАБОТ Скользящие группы(один остается за столом, группа перемещается)
- 31. Обсуждение полученной информацииВот вы и вернулись в
- 32. ЗакреплениеОтветьте на вопросы:1. Как вы объясните выражение -активность
- 33. Задание №4 (3 баллов)Задача: Какова масса меди,
- 35. Итог урока
- 36. Критерии оценивания23-27 баллов- «5»18-23 балла – «4»12-17 баллов – «3»меньше 11 баллов – «2»
- 37. Домашнее заданиеН.Н. Нурахметов, Химия, 9 класс, Алматы, Мектеп,2013 г§ 30 стр140, задание №4,6,7 стр 143
- 38. Скачать презентацию
- 39. Похожие презентации
Электрохимический ряд напряжения металлов. Активность металлов9 класс

































Слайд 4
Языковая цель
Учащиеся могут:
• Правильно использовать химические термины, понимать и
отвечать на поставленные учителем вопросы в разрезе изучаемой темы
и известных фактах.Ключевые слова и фразы:
• Электрохимический ряд, напряжение металлов, активность металлов, окислитель, восстановитель, вытеснение.
Вопросы для обсуждения:
• Можете ли вы сказать, почему металлы в электрохимическом ряду располагаются в порядке ослабления восстановительных свойств?
• В электрохимическом ряду, Бекетов среди металлов, поместил неметалл – водород, как вы обоснуете его действия?
Слайд 5
Ожидаемый результат
Объяснить понятие - электрохимический ряд напряжения металлов.
Составлять
уравнения реакций замещения металлов в растворах их солей более
активными металлами.Объяснять механизм работы с электрохимическим рядом напряжения металлов.
Проводить исследование с использованием прибора GLX Explorer и сенсорным температурным датчиком.
Составлять свой вытеснительный ряд металлов, на основании проведенных опытов и исследований.
Обосновывать результаты проведенных исследований и опытов, а также смогут объяснить принцип протекторной защиты от коррозии.
Слайд 6
Оценивание.
Устное поощрение выполненной работы;
Самооценивание и взаимооценивание по ключу;
Оценочные
листы (критериальное оценивание);
Как вы планируете увидеть приобретенные знания учащихся?
• Учащиеся
составляют уравнения реакций, правильно проводят сбор данных с прибора, проводят опыты, доказывают верность составления электрохимического ряда Бекетова на основании собственного вытеснительного ряда, решают задачи.
Слайд 9
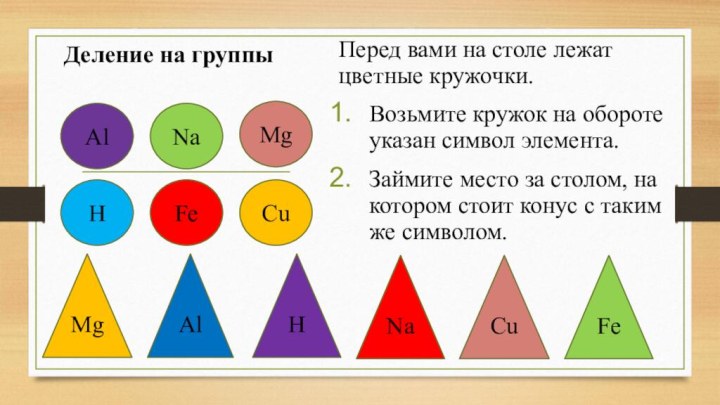
Деление на группы
Перед вами на столе лежат цветные
кружочки.
Возьмите кружок на обороте указан символ элемента.
Займите место за
столом, на котором стоит конус с таким же символом.H
Fe
Cu
Mg
Al
H
Al
Mg
Na
Fe
Cu
Na
Слайд 11
1. Металлы занимают верхний левый угол в ПСХЭ.
2. В кристаллах
атомы металла связаны металлической связью.
3. Валентные электроны металлов крепко связаны
с ядром.4. В группе сверху вниз происходит увеличение восстановительных свойств металлов.
5. Чтобы оценить активность металла в растворах кислот и солей, достаточно посмотреть в электрохимический ряд напряжения металлов.
Слайд 12
Я уверена, вы справились с этим заданием.
Внимание!
Проверьте свои ответы по ключу на экране и поставьте
себе заработанные баллы в соответствии с правильными ответами. За каждый правильный ответ – 1 балл,
в оценочный лист запишите общее количество баллов.
Слайд 13
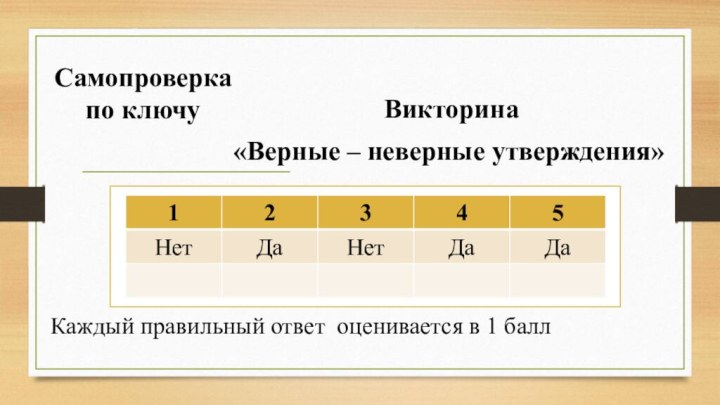
Самопроверка по ключу
Викторина
«Верные – неверные утверждения»
Каждый
правильный ответ оценивается в 1 балл
Слайд 15
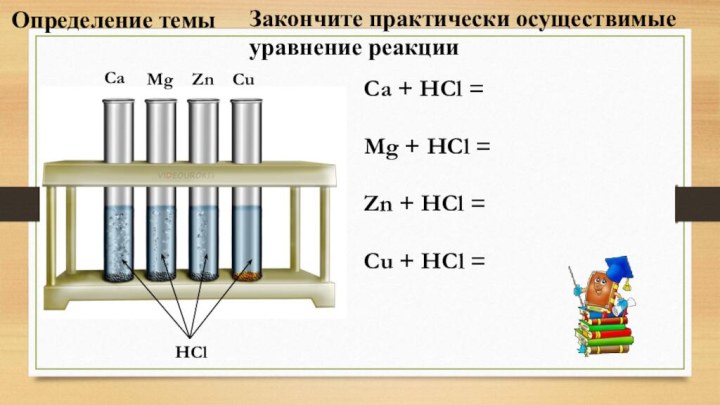
Ca + HCl =
Mg + HCl =
Zn
+ HCl =
Cu + HCl =
HCl
Ca
Mg
Zn
Cu
Определение темы
Закончите практически осуществимые
уравнение реакции
Слайд 16
Внимание!!!
За каждое правильное уравнение реакции -1 балл
Взаимопроверка работ
по часовой стрелке
Слайд 17
Ca + 2HCl = CaCl2 + H2↑
Mg +
2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2
+ H2↑Cu + HCl ≠
Закончите практически осуществимые уравнение реакции
Объясните почему в этом задании есть уравнения осуществимые и практически невозможные уравнения.
Слайд 19
(1827-1911)-академик. Предложил и обосновал вытеснительный ряд металлов
Учитывая различные
восстановительные свойства металлов Н.Н. Бекетов в 1865 г. Составил
вытеснительный ряд активности металлов и включил в него водород.http://aida.ucoz.ru
Бекетов Николай Николаевич
Бекетов Николай Николаевич
Слайд 22
Работа в группах
ИНСЕРТ
Стр. 142-143
Группа №1, 4
Активность металлов
калий и литий в ПСХЭ и ЭХРНМ
Группа №2, 5
2.
Химическая сущность явлений ЭХРНМ. Группа № 3, 6
3. Почему водород попал в электрохимический ряд напряжений металлов?
Слайд 23
Работа в группах- ИНСЕРТ
Активность металлов калий и литий
в ПСХЭ и ЭХРНМ
Вывод: Чем меньше радиус иона, тем большее
электрическое поле вокруг него создается, тем больше энергии выделяется при гидратации, значит более сильные восстановительные свойства у этого металла в реакциях.2. Химическая сущность явлений положения металлов в ряду, определяет «стремление» их переходить в раствор в виде гидратированных ионов. Чем лучше гидратируются ионы того или иного металла (в зависимости от радиуса иона, от энергии кристаллической решетки и энергии гидратации), тем левее располагаются они в электрохимическом ряду напряжений металлов
3. Почему водород попал в электрохимический ряд напряжений металлов? Вывод: что одни металлы вытесняют водород из кислот, а другие нет, и это зависит от восстановительной способности металла.
Слайд 24
Внимание!!!
Команды оценивают друг друга. Продуктом вашей работы должны
быть правила расположения металлов в ЭХРНМ
Джигсо
Слайд 25
CuSO4
Cu
Принципы расположения металлов в ЭХРНМ
1. Уменьшаются восстановительные свойства
металлов
при реакциях в водных растворах в
стандартных условиях (250°С, 1 атм.);
2. Металл, стоящий левее, вытесняет металл, стоящий
правее из их солей в растворе;
3. Металлы, стоящие до водорода, вытесняют его из
кислот в растворе (искл.: HNO3);
4. Ме (до Al) + Н2О —> щелочь + Н2
Другие Ме (до Н2) + Н2О —> оксид + Н2
(жесткие условия)
Ме (после Н2) + Н2О —> не реагируют
Fe
Fe
Слайд 26
Лабораторный опыт- Группа №1, 3, 5
Ag
Работа с химическими
реактивами:
Осуществите превращения, запишите реакции
Zn + CuCl2→
Cu + HCl→
Mg +
HCl→Al + HCl→
Al+ CuCl2→
Составьте свой вытеснительный ряд металлов. Расположите их в порядке вытеснения друг друга, на основании проведенных опытов.
Слайд 27
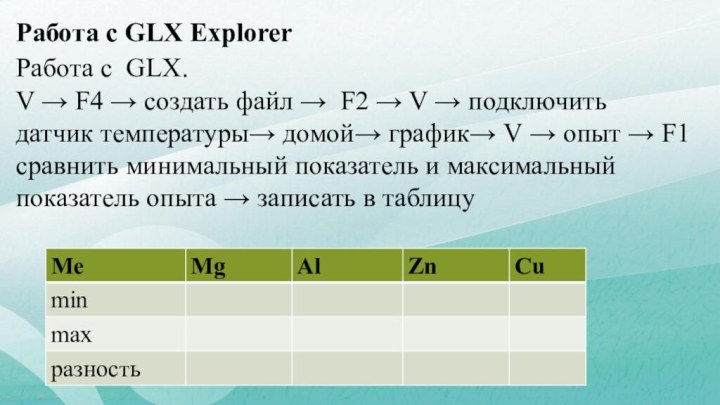
Работа с GLX Explorer
Налейте в 4 градуированные пробирки
по 1 мл р-ра HCl.
В первую пробирку опустите температурный
датчик и держите его в растворе 20 секунд, нажмите на (V)- пуск, чтобы начать запись данных. После 20 секунд, добавьте порошок магния к раствору соляной кислоты. Записывайте данные, пока показатели на датчике не стабилизируются. Нажмите (ОК). Внесите данные в таблицу. Опыт №2,3,4 с металлами – цинк, алюминий, медь проводятся аналогично первому опыту.Алгоритм анализа результатов опыта: Рассмотрите ваши графики температуры и времени, чтобы определить активность взаимодействия данных металлов с раствором соляной кислоты и максимальные показатели температуры при данной реакции- какая реакция будет более экзотермической.
Лабораторный опыт- Группа №2, 4, 6,
Слайд 28
Работа с GLX Explorer
Работа с GLX.
V → F4
→ создать файл → F2 → V → подключить
датчик температуры→ домой→ график→ V → опыт → F1 сравнить минимальный показатель и максимальный показатель опыта → записать в таблицу
Слайд 29
Итог работы:
Составьте свой вытеснительный ряд металлов.
Расположите их
в порядке вытеснения, на
основании собранных лабораторных данных.
Защитите
свою модель вытеснительного ряда металлов.
Слайд 30
МОЛОДЦЫ РЕБЯТА!
ЗАЩИТА РАБОТ
Скользящие группы
(один остается за столом,
группа перемещается)
Слайд 31
Обсуждение полученной информации
Вот вы и вернулись в свои
группы, теперь у вас есть время обсудить полученную информацию
и в своих оценочных листах прошу поставить оценку группам в которых вы получили информацию (оценивание проводите по пятибалльной системе оценивания)
Слайд 32
Закрепление
Ответьте на вопросы:
1. Как вы объясните выражение -активность металлов?
2. Можете
ли вы сказать, почему металлы в электрохимическом ряду располагаются
в порядке ослабления восстановительных свойств?3. В электрохимическом ряду, Бекетов среди металлов, поместил неметалл – водород, как вы обоснуете его действия?