Слайд 2
План
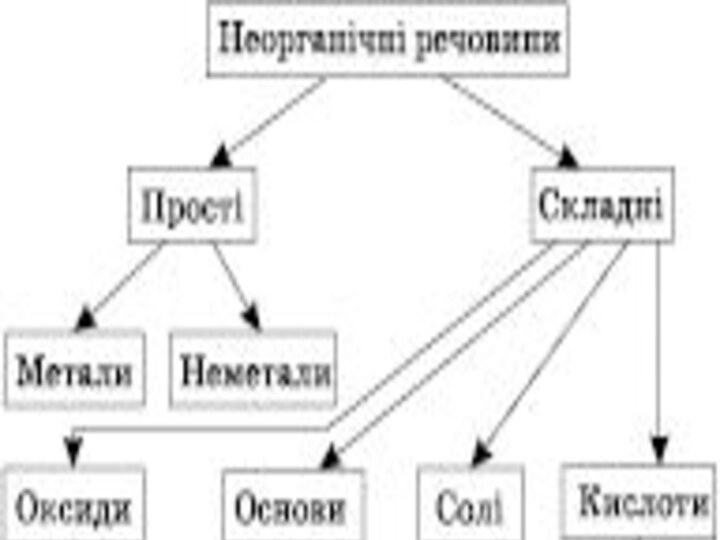
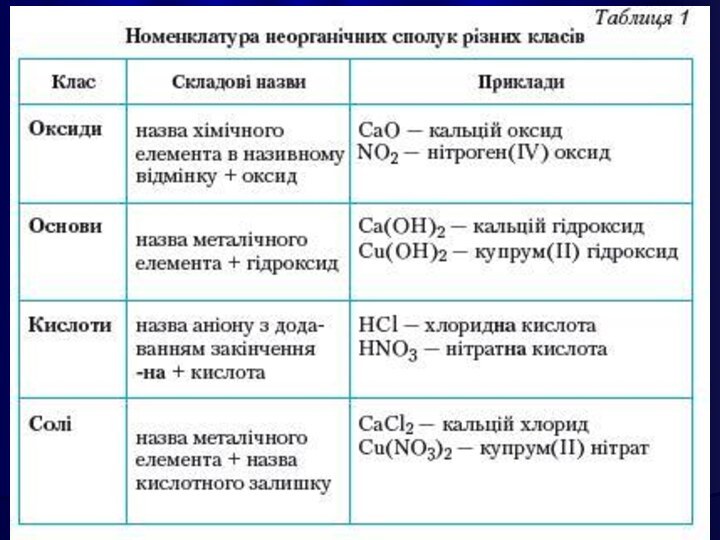
Оксиди.
2. Основи.
3. Кислоти.
4. Солі.
Слайд 4
Солетворні
Основні
(CaO, FeO) Кислотні
(CO2, P2O5) Амфотерні
(ZnO, Al2O3)
Несолетворні
(SiO2, CO, N2O)
Класифікація оксидів
Слайд 5
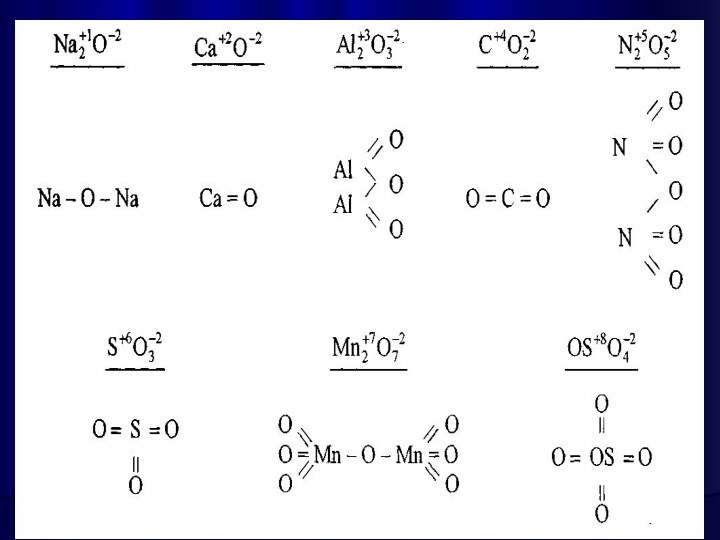
Окси́д — бінарна сполука, до складу якої входить
Оксиген.
Майже всі елементи утворюють оксиди. Їх загальні формули та
міжнародна номенклатура:
Слайд 6
Назва оксидів складається зі слова «оксид» з додаванням
спочатку назви елемента, що входить до складу речовини, у
називному відмінку.
Назви оксидів елементів зі змінною валентністю будують таким чином: після слова "оксид" вказують назву елементу і в дужках його валентність у цьому оксиді. Наприклад: СuО – оксид Купруму (II).
Слайд 8
ОСНОВНИМИ_ОКСИДАМИ
називають оксиди металів, гідрати яких є основами.
Наприклад:
Lі2O, Nа2O, К2O, Rb2O, CS2O, MgO, CaO, BaO, Cu2O,
Ag2O, Hg2O, VO, V2O3, MnO, Mn2O3 та інші.
Слайд 9
КИСЛОТНИМИ_ОКСИДАМИ
називають оксиди, гідрати яких є
кислотами.
Наприклад: Ва2О3, СО2, М2О5, Р2О5, С12О7, СrО3, V2O5, МnО3,
Мn2О7.
Слайд 10
АМФОТЕРНИМИ_ОКСИДАМИ
називають оксиди, гідрати яких є амфотерними гідроксидами.
Наприклад: А12О3, Сг2О3, ВеО, ZnО, SnО, Sn02, РbО, РbO2,
TiO2, МnO2 та інші.
Слайд 11
Методи одержання оксидів
Безпосереднім сполученням елементів з киснем:
2Zn
+ O2 = 2ZnO
4Р + 5О2 = 2Р2О5
Окисленням різних сполук киснем:
СН4 + 2О2 = СО2 + 2Н2О
2Н2S = СаО + Н2О
2Fe(ОН)3 = Fe2О3 + 3Н2О
Розкладом солей кисневих кислот при нагріванні:
CaCO3 = CaO + СО2
Розкладом гідроксидів при нагріванні:
Ca(ОН)2 О3 = CuO + СО2 + Н2О
Слайд 13
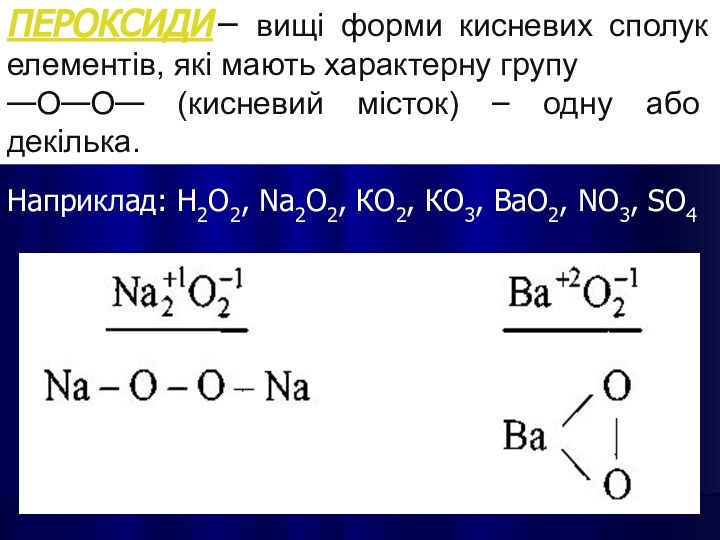
ПЕРОКСИДИ – вищі форми кисневих сполук елементів, які
мають характерну групу
—О—О— (кисневий місток) – одну або
декілька.
Наприклад: Н2О2, Nа2О2, КО2, КО3, ВаО2, NО3, SО4
Слайд 14
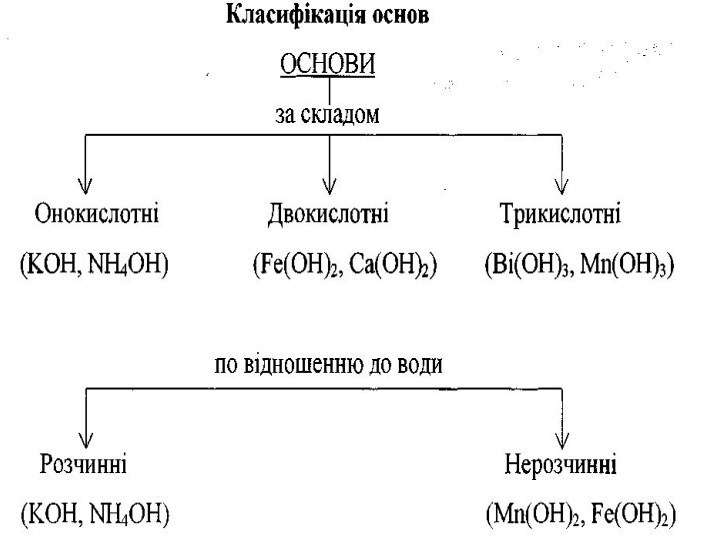
ОСНОВАМИ є сполуки основних
оксидів з водою, які мають гідроксильні
групи —ОН.
Назви основ: після слова "гідроксид" дається назва металу, який утворює основу, та в дужках римськими цифрами вказують його валентність
Слайд 18
Основи можна добути різними способами.
Безпосереднім сполученням основних оксидів
з водою.
Na2O + H2O = 2NaOH
Взаємодією
їдких лугів, з розчинами солей.
CuSO4 + 2KOH = Cu(OH)2 ↓ + K2SO4
Взаємодією найактивніших металів (K, Na, Ca, Ba) з водою.
2Na + 2H2O = 2NaOH + H2 ↑
Для технічного одержання NaOH і KOH широко використовують спосіб електролізу водних розчинів NaCl і KCl
Слайд 19
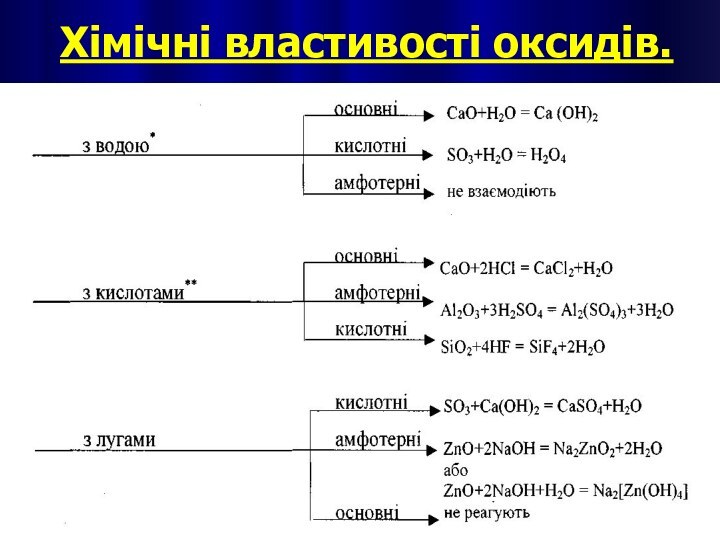
Хімічні властивості основ
1. Взаємодія основ з кислотними оксидами.
1.
Взаємодія основ з кислотними оксидами.
2. Взаємодія основ з кислотами.
Слайд 20
3. Взаємодія лугів з амфотерними оксидами.
4. Взаємодія лугів
з амфотерними гідроксидами.
5. Взаємодія лугів з солями.
Слайд 21
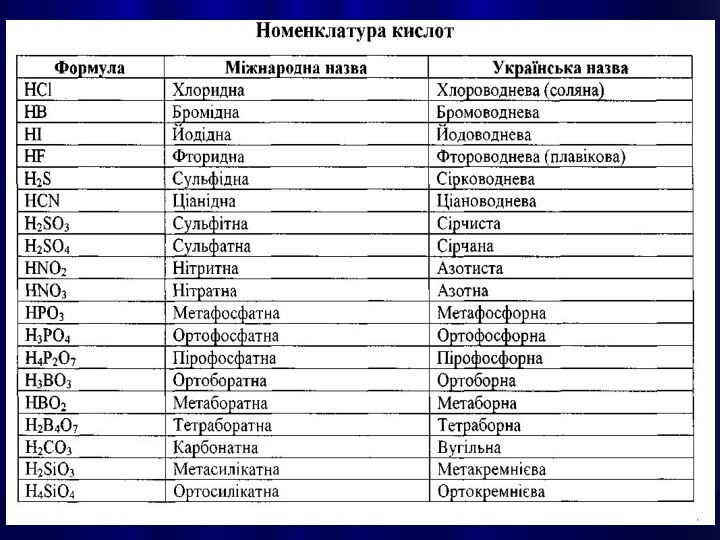
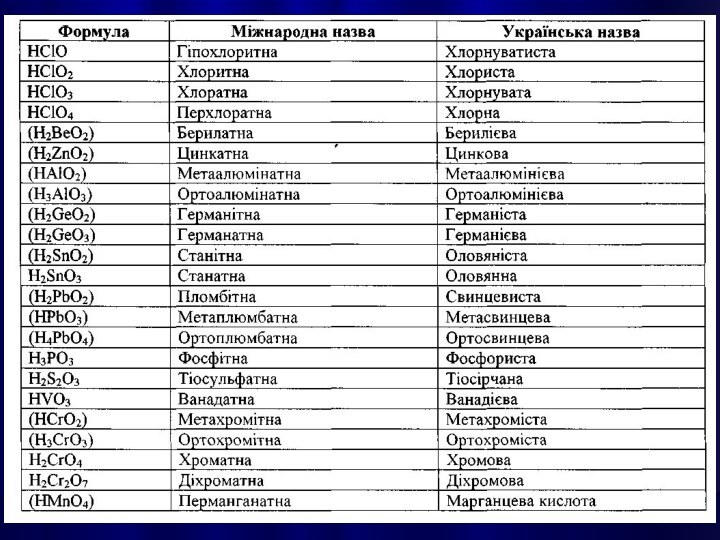
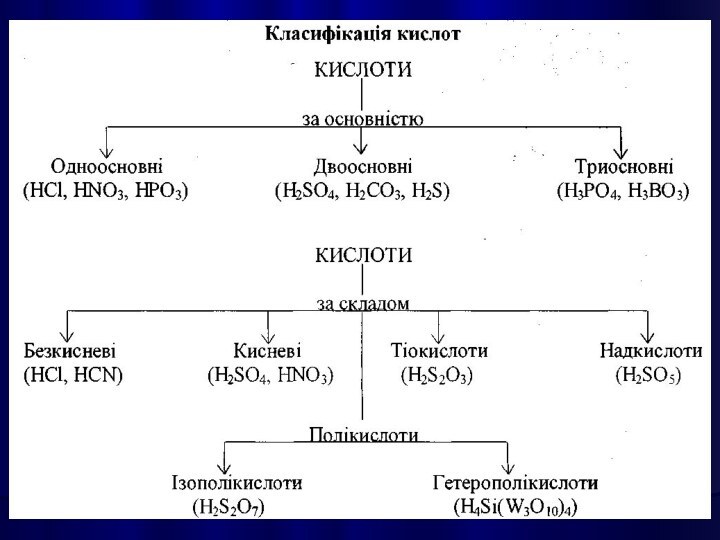
КИСЛОТАМИ називають сполуки, які містять атоми Гідрогену,
здатні заміщуватися на метал з утворенням солей.
Слайд 25
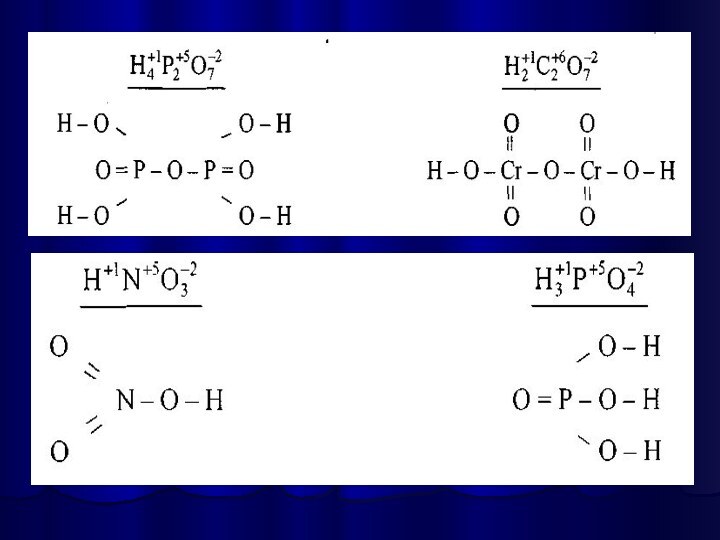
Написання графічної формули кислоти починають з кислотоутворюючого елементу,
потім справа від нього пишуть стільки груп —ОН, яка
основність кислоти. Решту атомів Оксигену записують зліва, з'єднуючи їх з кислотоутворюючим атомом подвійними зв'язками.
Слайд 28
Кислоти можна добувати різними способами.
Безпосереднім сполученням ангідридів з
водою:
SO3 + Н2О = Н2SO4
N2O5 + Н2О =
2HNO3
2. Взаємодією кислот з солями. Цим способом можна користуватися тоді, коли одержувана кислота є леткою або нерозчинною.
Н2SO4 + 2NaCl = Na2SO4 + 2HCl ↑ (при нагріванні)
H2SO4 + Na2SiO3 = Na2SO4 + H2SiO3 ↓
Слайд 29
3. Безкисневі кислоти можна одержувати як їх витісненням
з солей іншими кислотами, так і безпосереднім сполученням елементів
з наступним розчиненням одержуваних кислот у воді.
FeS + 2HCl = FeCl2 + H2S ↑
Н2 + Cl2 = 2HCl
Слайд 30
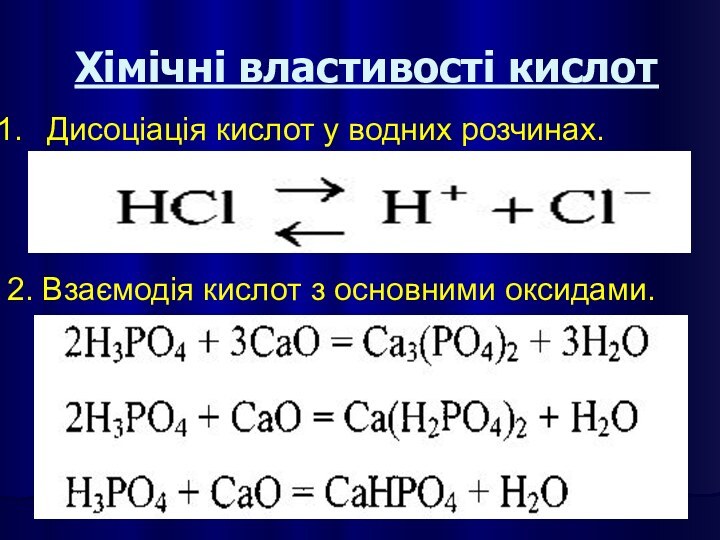
Хімічні властивості кислот
Дисоціація кислот у водних розчинах.
2. Взаємодія
кислот з основними оксидами.
Слайд 31
3. Взаємодія кислот з основами (реакція нейтралізації).
4. Взаємодія
кислот з амфотерними оксидами та гідроксидами.
Слайд 32
5. Взаємодія кислот з солями
6. Взаємодія кислот з
металами.
Слайд 33
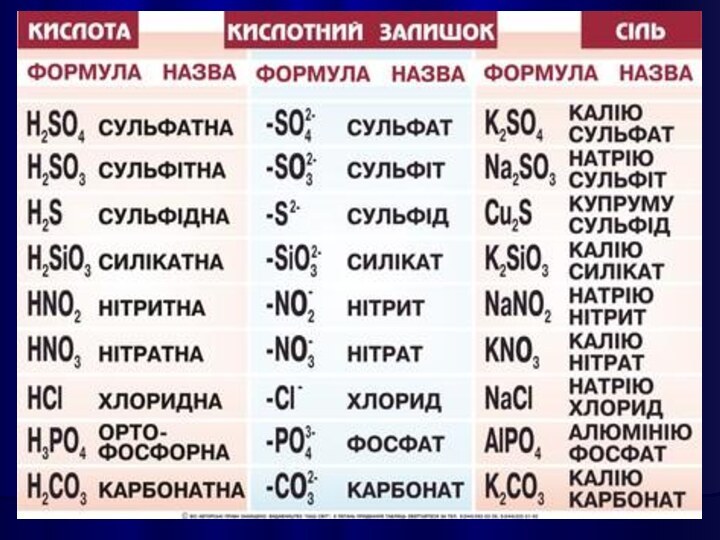
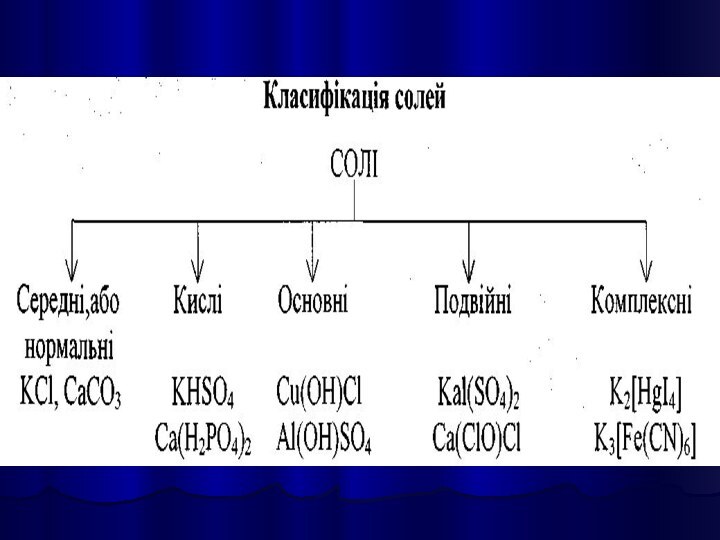
СОЛЯМИ є кристалічні речовини, які можна рахувати продуктами
повного або часткового зміщення атомів Гідрогену в молекулах кислот
на атоми металів, або гідроксильних груп в основах на кислотні залишки.
Слайд 35
Середні солі можна розглядати як продукти повного заміщення
атомів Гідрогену в молекулі кислоти на метал, або гідроксильних
груп в основах на кислотні залишки.
Кислі солі – продукти неповного заміщення атомів Гідрогену в кислоті на метал.
Основні солі – продукти неповного заміщення гіроксогруп в основах на кислотні залишки.
Подвійними є солі, які утворюються при заміщенні атомів Гідрогену в кислоти атомами різних металів, або при заміщенні гідроксильних груп в основах різними кислотними залишками.
Комплексні солі містять комплексний іон та іони зовнішньої сфери.
Слайд 37
Солі утворюються:
1. При взаємодії кислот з основами (реакції
нейтралізації):
2HNO3 + Ba(OH)2 = Ba(NO3)2 + 2H2O
2. При
взаємодії кислот з основними оксидами:
2HCl + CuO = CuCl2 + H2O
3. При взаємодії кислот з амфотерними оксидами:
3H2SO4 + Al2O3 = Al2(SO4)3 + 3H2O
Слайд 38
4. При взаємодії кислот з солями:
3H2SO4 + Ca3(PO4)2
= 2H3PO4 + 3CaSO4 ↓
5. При взаємодії кислот
з металами:
2HCl + Zn = ZnCl2 + H2 ↑
6. При взаємодії основ з кислотними оксидами:
2KOH + CO2 = K2CO3 + H2O
7. При взаємодії основ з солями:
2NaOH + CuCl2 = 2NaCl + Cu(OH)2 ↓
Слайд 39
8. При взаємодії основних оксидів з кислотними:
CaO +
CO2 = CaCO3
9. При взаємодії солей:
K2SO4 + BaCl2
= 2KCl + BaSO4 ↓
10. При взаємодії солей з металами:
CuSO4 + Zn = ZnSO4 + Cu
11. При взаємодії металів з неметалами:
Mg + Cl2 = MgCl2
Слайд 40
Хімічні властивості солей
1. Дисоціація солей у водних розчинах.
2.
Гідроліз солей – взаємодія солі з водою:
Слайд 41
3. Взаємодія солей з лугами (розчинними основами):
4. Взаємодія
солей з кислотами:
5. Взаємодія між солями.