- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Медь, серебро, золото
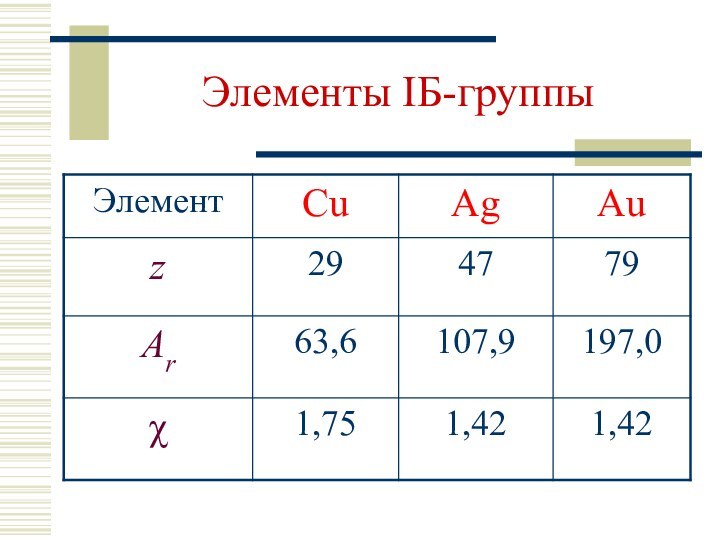
Содержание
- 2. Элементы IБ-группы
- 3. Элементы IБ-группы Общая электронная формула:[…] ns1 (n–1)d10
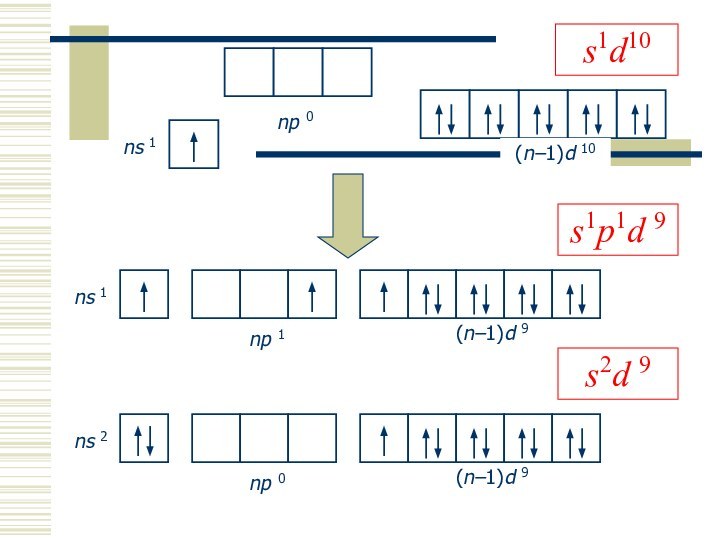
- 4. s2d 9s1p1d 9
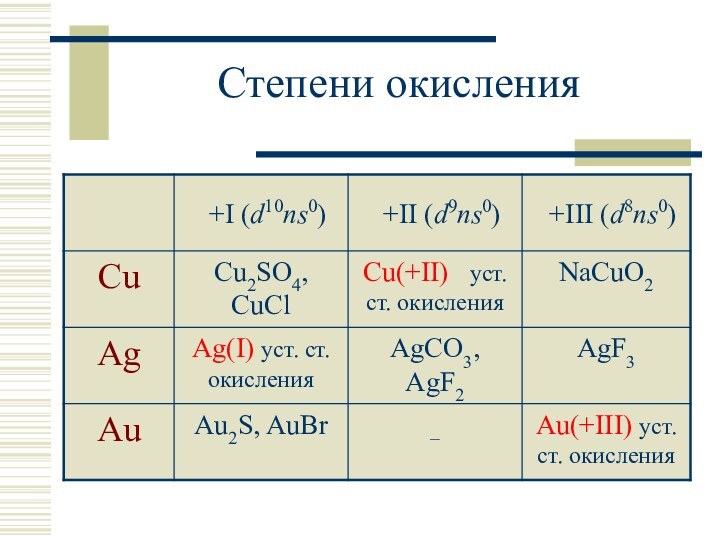
- 5. Степени окисления
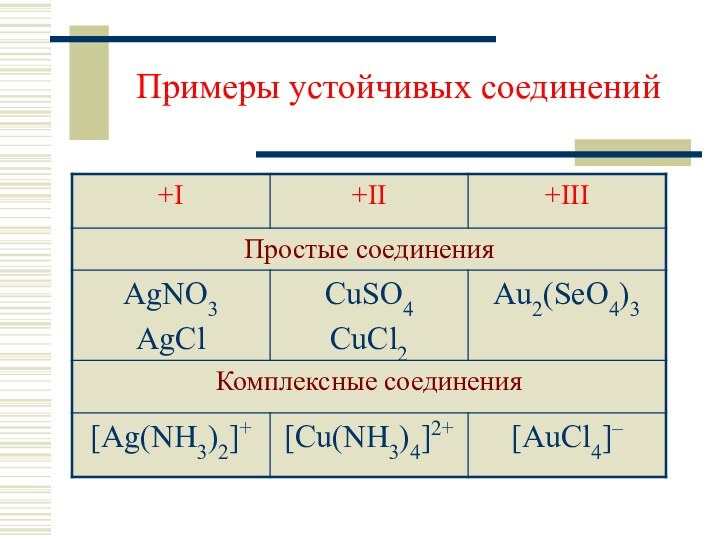
- 6. Примеры устойчивых соединений
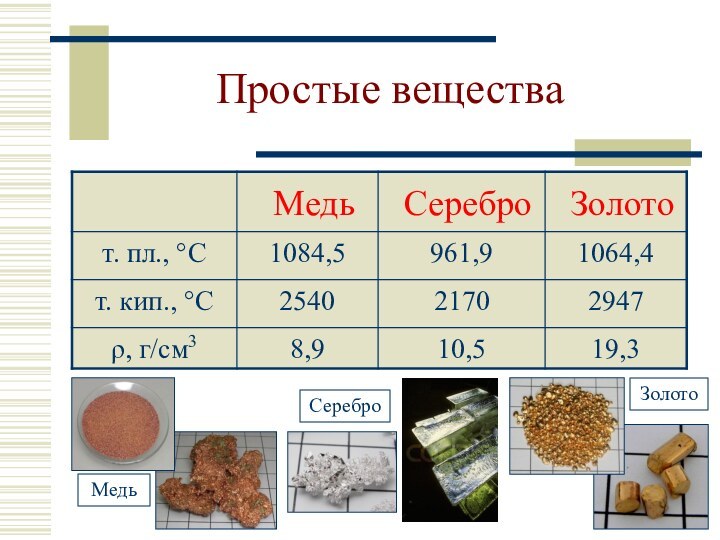
- 7. Простые вещества
- 8. В ЭХРН: …H ... Cu …Ag …Au
- 9. Химическое растворениеВ «царской водке» (до ст. ок.
- 10. Кислородные соединения Cu
- 11. ЭIБC, H2, N2Г2CuCl CuF2 CuF CuCl2 CuI
- 12. Распространение в природе и важнейшие минералы В
- 13. Минералы халькопирит (FeCu)S2халькозин Cu2Sковеллин CuSкуприт Cu2Oмалахит Cu2(CO3)2(OH)2аргентит Ag2Sхлораргирит AgClкалаверит AuTe2
- 14. Получение меди2(FeIIICuI)S2 + 5 O2 + 2SiO2
- 15. Выплавка медиРафинирование меди электролизомЗагрузка печиПульт управленияОчищенная медь
- 16. Добыча золота
- 17. Цианидный метод извлечения золота и серебра
- 18. Особенности химии меди2Cu+I Cu0 + Cu2+
- 19. Гидроксид Cu(OH)2Получение: Cu2+ + 2OH─ = Cu(OH)2
- 20. Комплексные соединения Cu2+(р): [Cu(H2O)4(H2O)2]2+ [Cu(H2O)4(H2O)2]2+ + 4NH3·H2O
- 21. Комплексные соединения dsp2 (квадрат):[Cu(H2O)2(OH)4]2–, [Cu(H2O)2Cl4]2–,
- 22. Окислительно-восстановительные свойства2[Cu(H2O)4]2+ + 4I = 2CuI +
- 23. СереброAg – уникальный элемент:нет гидратов солейнет аквакомплексовРастворимые
- 24. Скачать презентацию
- 25. Похожие презентации

![Медь, серебро, золото Элементы IБ-группы Общая электронная формула:[…] ns1 (n–1)d10 Степени окисления: 0, +I, +II,](/img/tmb/14/1308432/a7eab35332c115e52999cea710f03236-720x.jpg)











![Медь, серебро, золото Комплексные соединения Cu2+(р): [Cu(H2O)4(H2O)2]2+ [Cu(H2O)4(H2O)2]2+ + 4NH3·H2O = = [Cu(NH3)4(H2O)2]2+ + 8H2OДлинные](/img/tmb/14/1308432/128e42625bd620001f31a9f4c61d7120-720x.jpg)
![Медь, серебро, золото Комплексные соединения dsp2 (квадрат):[Cu(H2O)2(OH)4]2–, [Cu(H2O)2Cl4]2–, [Cu(NH3)2(H2O)2(NO2)2] sp3 (тетраэдр):[Cu(OH)4]2 (в усл.](/img/tmb/14/1308432/3b7f466eead161502a0ee07e519720f6-720x.jpg)
![Медь, серебро, золото Окислительно-восстановительные свойства2[Cu(H2O)4]2+ + 4I = 2CuI + I2 + 8H2O](/img/tmb/14/1308432/389c6702ad2d6f388a0e1522f5110fa3-720x.jpg)


Слайд 3
Элементы IБ-группы
Общая электронная формула:
[…] ns1 (n–1)d10
Степени окисления: 0, +I, +II, +III
(sp -гибр., линейн.), 4 (dsp 2-гибр., квадрат; sp 3-гибр., тетраэдр)
Слайд 8
В ЭХРН: …H ... Cu …Ag …Au
Сu2+/Cu
Ag+/Ag [AuСl4]–/Au, В: +0,34 +0,799 +1,00
ЭIБ + H2O
ЭIБ + H3O+
CuAg
H2SO4(конц.) HNO3(конц.) HNO3(разб.)
Cu2+ Ag+
Слайд 9
Химическое растворение
В «царской водке» (до ст. ок. +III)
Au
+ HNO3 + 4HCl = H[AuCl4] + NO +
2H2OВ расплаве селеновой кислоты (до ст. ок. +III)
2Au + 6H2SeO4 = Au2(SeO4)3 + 3SeO2 + 6H2O
В щелочной среде (до ст. ок. +I)
2Cu + 8(NH3.H2O) + O2 =
= 2[Cu(NH3)4]2+ + 4OH + 6H2O
2Cu + 4CN + 2H2O = 2[Cu(CN)2] + 2OH + H2
4Ag + 8CN + 2H2O + O2 = 4[Ag(CN)2] + 4OH
Слайд 10 Кислородные соединения Cu
Ag, Au
+I: Cu2O уст. красн., т. пл. 1240 С
+II: CuO черн., разл. до Cu2O и O2 (1026 С)
Cu(OH)2 синий, амфотерн., разл. до CuO и H2O (40-80 С)
+III: Cu2O3 т-ра разл. 400 С (до CuO и O2 )
+I: Ag2O разл. до Ag и O2 (160 С )
+II: «Ag2O2» (AgIAgIIIO2) диамагнитен, разл. до Ag2O и O2 (100 С)
+III: Au2O3 амфотерн., разл. до Au и O2 (160 С)
Au2O3 · 2H2O амфотерный (Kк Kо) – «золотая кислота»
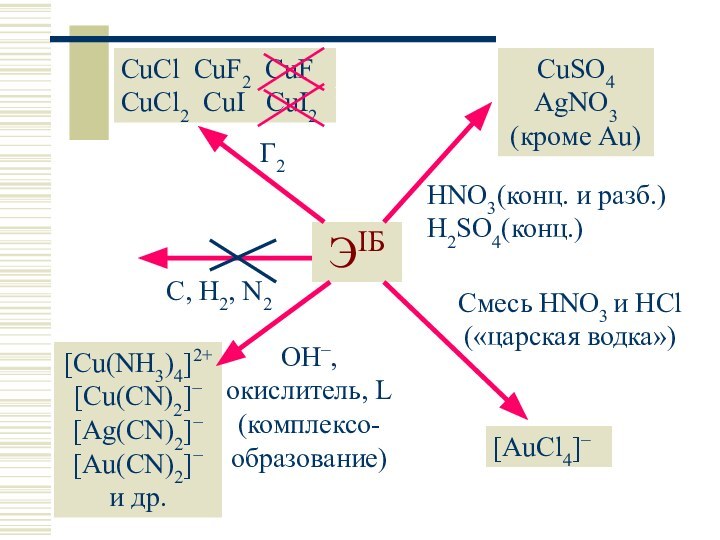
Слайд 11
ЭIБ
C, H2, N2
Г2
CuCl CuF2 CuF CuCl2 CuI
CuI2
CuSO4 AgNO3 (кроме Au)
HNO3(конц. и разб.) H2SO4(конц.)
Смесь HNO3 и
HCl («царская водка»)[AuCl4]–
OH–, окислитель, L (комплексо-образование)
[Cu(NH3)4]2+ [Cu(CN)2] [Ag(CN)2] [Au(CN)2] и др.
Простые вещества
Слайд 12
Распространение в природе и важнейшие минералы
В земной
коре:
26. Cu 0,01% масс.
69. Ag 1·10–5 % масс.
75. Au
5·10–5 % масс.
Слайд 13
Минералы
халькопирит (FeCu)S2
халькозин Cu2S
ковеллин CuS
куприт Cu2O
малахит Cu2(CO3)2(OH)2
аргентит Ag2S
хлораргирит
AgCl
калаверит AuTe2
Слайд 14
Получение меди
2(FeIIICuI)S2 + 5 O2 + 2SiO2 =
2Cu0 + 2FeSiO3 + 4SO2
халькопирит…обжиг/связывание FeII ………шлак……. газ
Cu+I
+ 1e– = Cu0Fe+III + 1e– = Fe+II
2S–II – 12e– = 2S+IV
O2 + 4e– = 2O–II
Выплавляемую «черновую» медь рафинируют электролитически.
Слайд 17
Цианидный метод извлечения золота и серебра
ЭIБ(Ag,Au)
+ NaCN(р) + O2 [Э(CN)2] + OH
измельч.руда….……………..воздух……р-р, рН
> 7, выделение HCN (гидролиз)
2[Э(CN)2] + Zn(тв., пыль) = [Zn(CN)4]2 + 2Э(т)
Zn + 2HCl = ZnCl2 + H2 (удаление избытка Zn)
Слайд 18
Особенности химии меди
2Cu+I Cu0 + Cu2+
Cu2O
+ H2SO4 =
= Cu0 + CuSO4 + H2O
Cu2O + 2HCl = 2CuCl + H2OCuCl + HCl = H[CuCl2]
Cu2O + 4(NH3·H2O) =
= 2[Cu(NH3)2]OH + 3H2O
КЧ(CuI) = 2, sp-гибр.
Получение:
4Cu(OH)2 + N2H4·H2O = = 2Cu2O + N2 + 7H2O
Слайд 19
Гидроксид Cu(OH)2
Получение:
Cu2+ + 2OH─ = Cu(OH)2
Амфотерность:
Cu(OH)2 + 2H3O+ =
= [Cu(H2O)4]2+
Cu(OH)2 + 2OH =
= [Cu(OH)4]2
Cu(OH)2 = CuO + H2O
синий черный
t°
Слайд 20
Комплексные соединения Cu2+(р): [Cu(H2O)4(H2O)2]2+
[Cu(H2O)4(H2O)2]2+ + 4NH3·H2O =
= [Cu(NH3)4(H2O)2]2+ + 8H2O
Длинные транс-связи:
Cu–N: 205 пм,
Cu–O: 337
пм[Cu(NH3)6]2+ можно получить в среде жидкого аммиака
в воде условно для [CuL4]2+ КЧ(CuII) = 4, dsp2-гибр. (квадрат)
см. эффект Яна-Теллера
sp3d2, искаж. октаэдр
Слайд 21
Комплексные соединения
dsp2 (квадрат):
[Cu(H2O)2(OH)4]2–, [Cu(H2O)2Cl4]2–, [Cu(NH3)2(H2O)2(NO2)2]
sp3 (тетраэдр):
[Cu(OH)4]2 (в усл. изб. щелочи, рН 11)
Аммиачный
к-с меди(II): получение и разрушение
Слайд 22
Окислительно-восстановительные свойства
2[Cu(H2O)4]2+ + 4I = 2CuI + I2
+ 8H2O
Cu2+ + I– + e–=
CuI (CuII – мягкий окислитель)2I– – 2e– = I2
В р-ре: [I(I)2]–, CuI (суспензия)
I2 + 2SO3S2– = 2I– + S4O62–
Растворение за счет комплексообразования:
CuI(т) + 2 SO3S2–= [Cu(SO3S)2]3– + I–
CuI(т) + 2Na2SO3S = Na3[Cu(SO3S)2] + NaI
Слайд 23
Серебро
Ag – уникальный элемент:
нет гидратов солей
нет аквакомплексов
Растворимые соли:
AgNO3, AgClO4, AgClO3, AgF
Комплексообразование (растворение осадка):
AgX(т) + 2NH3·H2O
= = [Ag(NH3)2]X + 2H2O (КЧ 2)
AgX(т) + 2Na2SO3S = Na3[Ag(SO3S)2] (КЧ 2)





























