- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему: Окислительно-восстановительные реакции.
Содержание
- 2. Химические реакцииПо изменению степени окисления атомов элементовОкислительно-восстановительныеБез
- 3. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИОкислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
- 4. Окислитель и восстановитель Окислителем называют реагент, который принимает
- 5. ПРОЦЕСС ОКИСЛЕНИЯ И ВОССТАНОВЛЕНИЯОкислением называют процесс отдачи
- 6. Составление окислительно-восстановительных реакцийДля составления окислительно-восстановительных реакций используют метод электронного баланса
- 7. Составление окислительно-восстановительных реакций методом электронного балансаМетод основан
- 8. Алгоритмическое предписание для составления уравнений окислительно-восстановительных
- 9. Алгоритмическое предписание для составления уравнений окислительно-восстановительных
- 10. Алгоритмическое предписание для составления уравнений окислительно-восстановительных
- 11. Скачать презентацию
- 12. Похожие презентации
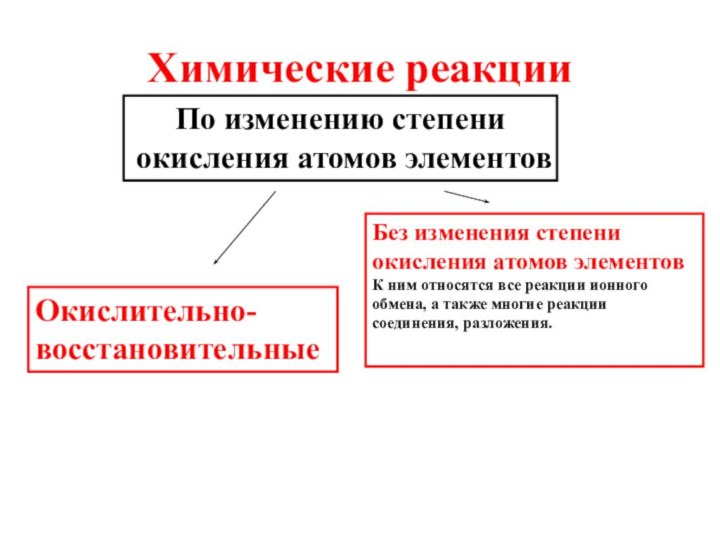
Химические реакцииПо изменению степени окисления атомов элементовОкислительно-восстановительныеБез изменения степени окисления атомов элементовК ним относятся все реакции ионного обмена, а также многие реакции соединения, разложения.










Слайд 2
Химические реакции
По изменению степени окисления атомов элементов
Окислительно-восстановительные
Без изменения
степени окисления атомов элементов
обмена, а также многие реакции соединения, разложения.
Слайд 3
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительными
называют реакции, которые сопровождаются
изменением степеней окисления химических элементов, входящих в состав реагентов.
Слайд 4
Окислитель и восстановитель
Окислителем называют реагент, который принимает электроны
в ходе окислительно-восстановительной реакции.
Восстановителем называют реагент, который отдает электроны
в ходе окислительно-восстановительной реакции.
Слайд 5
ПРОЦЕСС ОКИСЛЕНИЯ И ВОССТАНОВЛЕНИЯ
Окислением называют процесс отдачи электронов
атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением
называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Слайд 6
Составление окислительно-восстановительных реакций
Для составления окислительно-восстановительных реакций используют
метод электронного баланса
Слайд 7
Составление окислительно-восстановительных реакций методом электронного баланса
Метод основан на
сравнении степеней окисления атомов в исходных веществах и продуктах
реакции и на балансировании числа электронов, смещаемых от восстановителя к окислителю.Слайд 8 Алгоритмическое предписание для составления уравнений окислительно-восстановительных
реакций методом электронного баланса
1.Составить схему реакции.
2. Определить степени
окисления элементов в реагентах и продуктах реакции.3. Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов. В первом случае выполнить все последующие операции.
4. Подчеркнуть элементы, степени, окисления которых изменяются.
Слайд 9 Алгоритмическое предписание для составления уравнений окислительно-восстановительных
реакций методом электронного баланса
5. Определить, какой элемент окисляется
(его степень окисления повышается) и какой элемент восстанавливается (его степень окисления понижается) в процессе реакции.6. В левой части схемы обозначить с помощью стрелок процесс окисления (смещения электронов от атома элемента) и процесс восстановления (смещения электронов к атому элемента)
7. Определить восстановитель (атом элемента, от которого смещаются электроны) и окислитель (атом элемента, к которому смещаются электроны).
Слайд 10 Алгоритмическое предписание для составления уравнений окислительно-восстановительных
реакций методом электронного баланса
8. Сбалансировать число электронов между
окислителем и восстановителем.9. Определить коэффициенты для окислителя и восстановителя, продуктов окисления и восстановления.
10. Записать коэффициент перед формулой вещества, определяющего среду раствора.
11. Проверить уравнение реакции.