- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему 2. Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Содержание
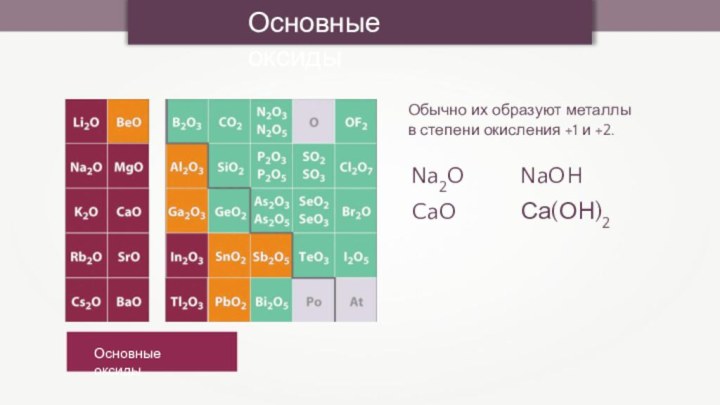
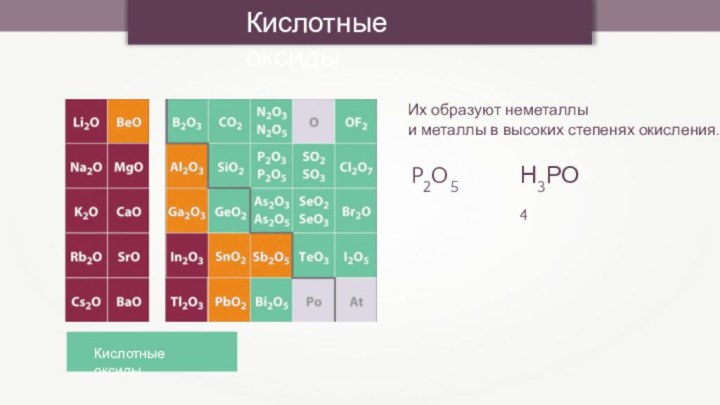
- 2. Кислотные оксидыКислотные оксидыИх образуют неметаллы и металлы в высоких степенях окисления.P2O5Н3РО4
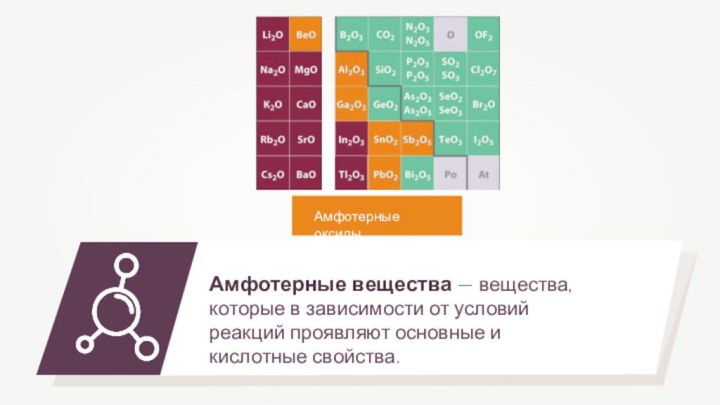
- 3. Амфотерные оксидыАмфотерные оксиды
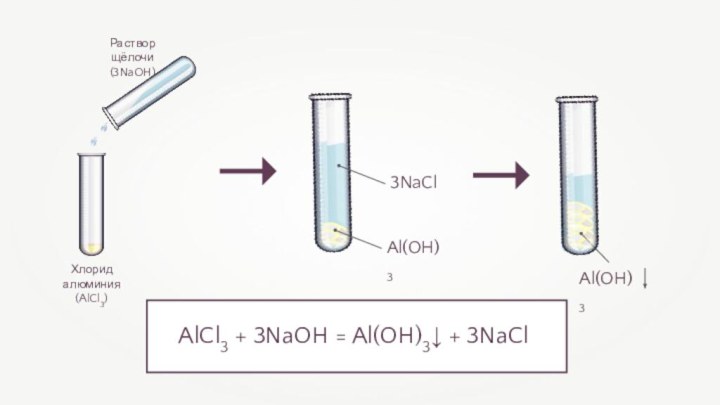
- 4. Хлорид алюминия(AlCl3)Раствор щёлочи(3NaOH)
- 6. Амфотерные вещества — вещества, которые в зависимости
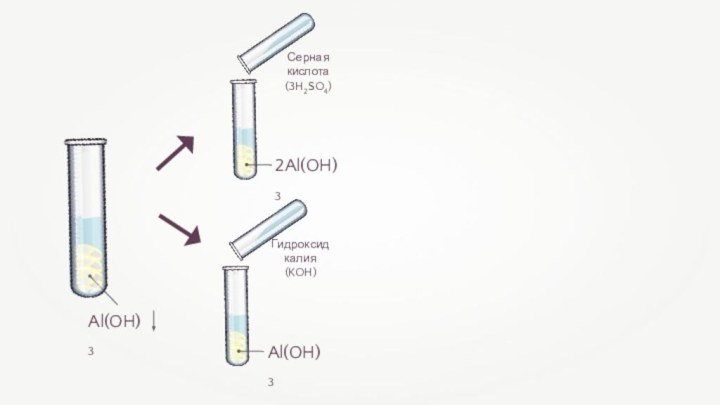
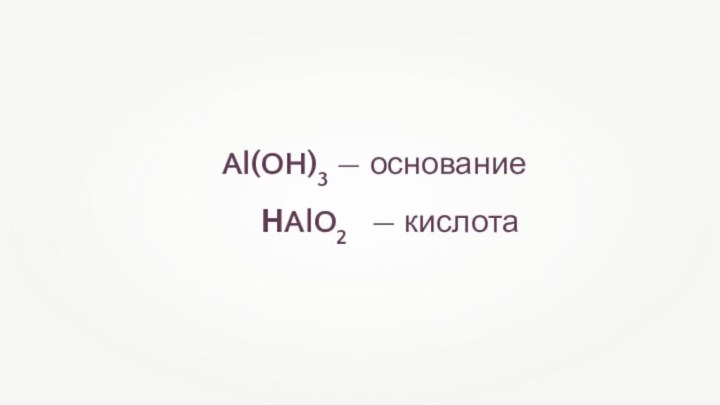
- 7. Al(OH)3 — основание НAlO2 — кислота
- 9. Al(OН)3 + KOH = K[Al(OH)4]
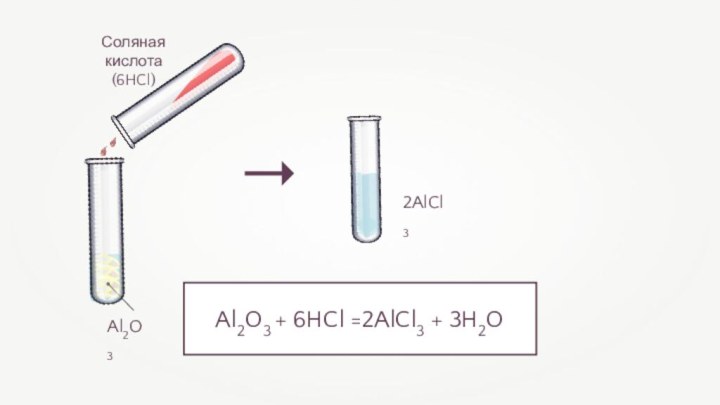
- 10. Al2O3 + 6HCl =2AlCl3 + 3H2O Соляная кислота(6HCl)
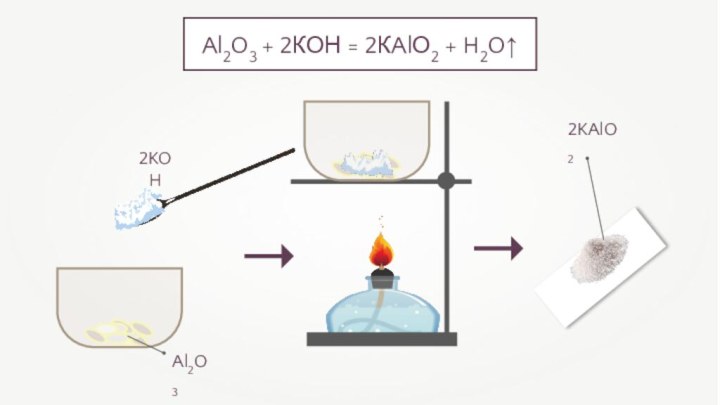
- 11. 2KOHAl2O3 + 2КОН = 2КAlО2 + H2O↑ Al2O32KAlO2
- 12. Амфотерные оксидыОксиды и гидроксиды цинка Оксиды и гидроксиды бериллия Оксиды и гидроксиды хрома ZnOZn(OH)2BeOBe(OH)2Cr2O3 Cr(OH)3
- 13. Скачать презентацию
- 14. Похожие презентации
Кислотные оксидыКислотные оксидыИх образуют неметаллы и металлы в высоких степенях окисления.P2O5Н3РО4


![2. Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Al(OН)3 + KOH = K[Al(OH)4]](/img/tmb/7/669568/8c9f9c69b2fd49a4041c687d2758ce73-720x.jpg)