- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Алкіни
Содержание
- 2. ПланПлан:1.Алкіни. Визначення2.Будова алкінів3.Номенклатура та ізомерія4.Фізичні властивості5.Добування6.Хімічні властивості7. Вплив на організм людини8.Застосування9.Застосування в медицині10.Цікаві факти
- 3. 1.Алкіни визначенняАлкіни(Ацетиленові)— це ненасичені вуглеводні, в молекулах
- 4. 2.Будова алкінівПершим і основним представником гомологічного ряду
- 5. В алкінах атоми С знаходяться у третьому
- 7. 3.Номенклатура та ізомеріяНоменклатураМолекули алкінів мають закінчення: -ін.Гомологічний
- 8. Ізомерія:1)Міжкласова(Алкадієни) СН3—СН2—СН2—СН2—С≡СН Гекс-1-ін СН3—СН2—СН2=СН2—С=СН Гекс-1,3-ен 2)Структурна 2.1 По
- 9. 4. Фізичні властивості При звичайних умовах (С2-С4)
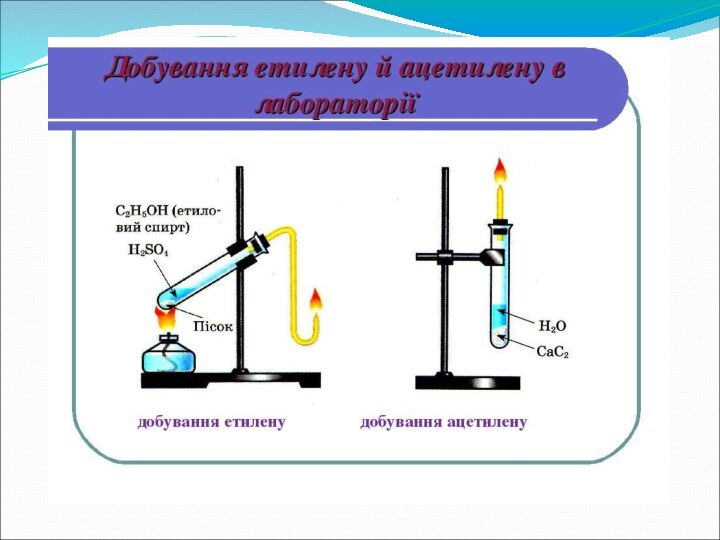
- 10. 5. Отримання алкінів 1. В промисловості:1. Крекинг
- 12. 6.Хімічні властивості На повітрі ацетилен горить кіптявим
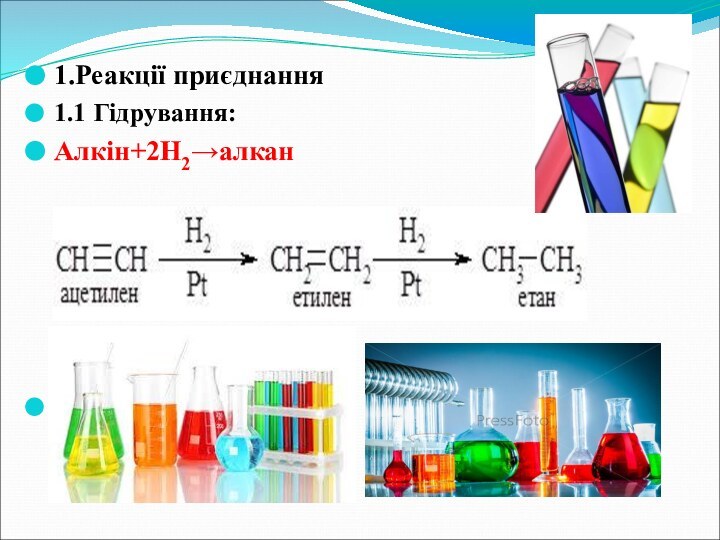
- 13. 1.Реакції приєднання1.1 Гідрування: Алкін+2Н2→алкан
- 14. 1.2ГалагенуванняАлкін+2Наl2→тетрагалагеноалкан
- 15. Правила Марковнікова:Атом Н приєднується до більш гідрогенізованого
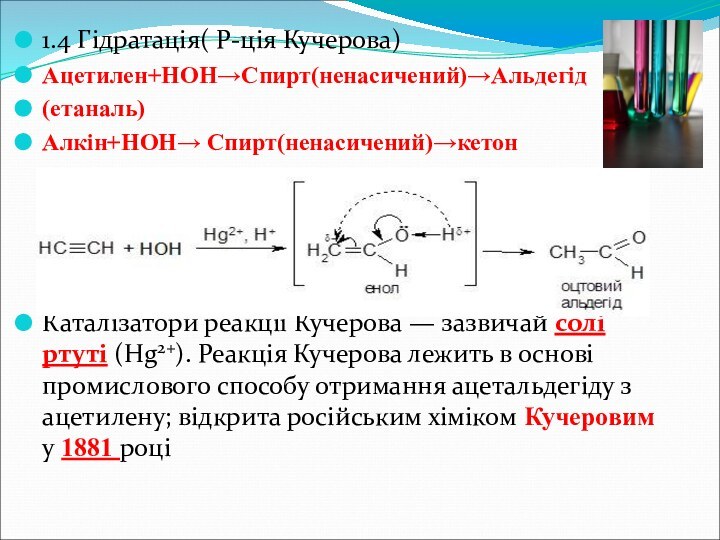
- 16. 1.4 Гідратація( Р-ція Кучерова)Ацетилен+НОН→Спирт(ненасичений)→Альдегід(етаналь)Алкін+НОН→ Спирт(ненасичений)→кетонКаталізатори реакції Кучерова —
- 17. КУЧЕРОВ Михайло Григорович3 червня 1850 р.
- 18. Правило ЕльтековаЗдатність ненасичених спирті ізомерезуватись до альдегідів
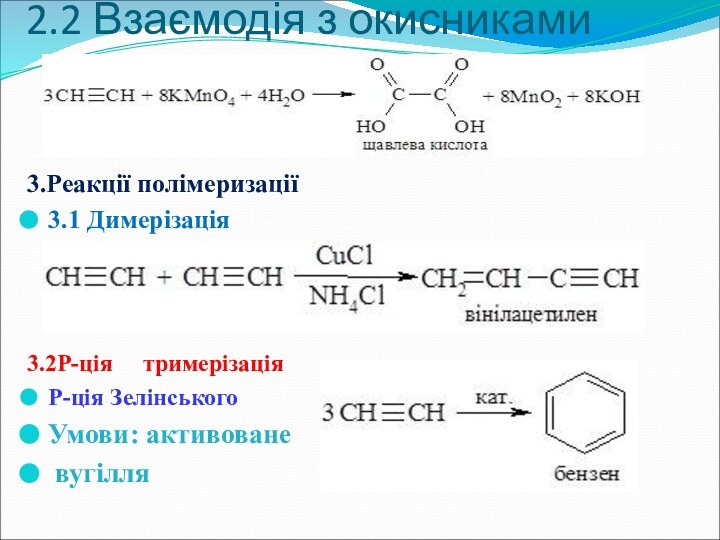
- 19. 2.2 Взаємодія з окисниками 3.Реакції полімеризації3.1 Димерізація3.2Р-ція тримерізаціяР-ція ЗелінськогоУмови: активоване вугілля
- 20. 4.Р-ція заміщенняАлкіни, які мають ≡ на початку
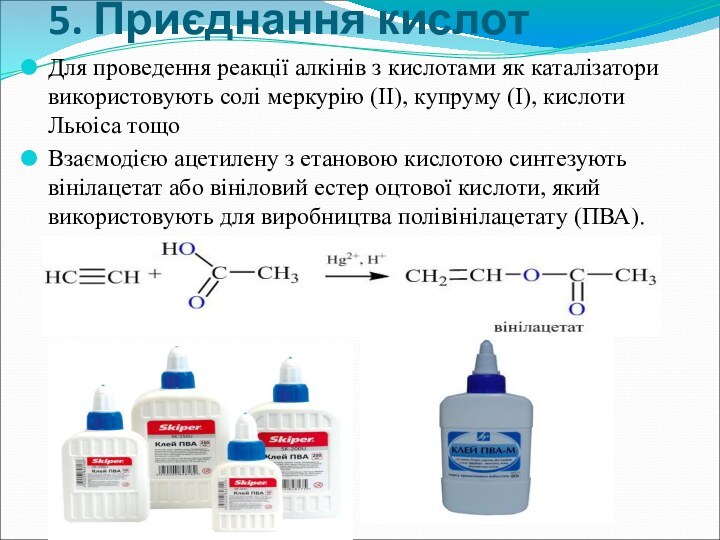
- 21. 5. Приєднання кислот Для проведення реакції алкінів
- 22. Взаємодією ціанідної кислоти з ацетиленом синтезують інший
- 23. 7. Якісні реакціїРеакція алкінів з аміакатами аргентуму
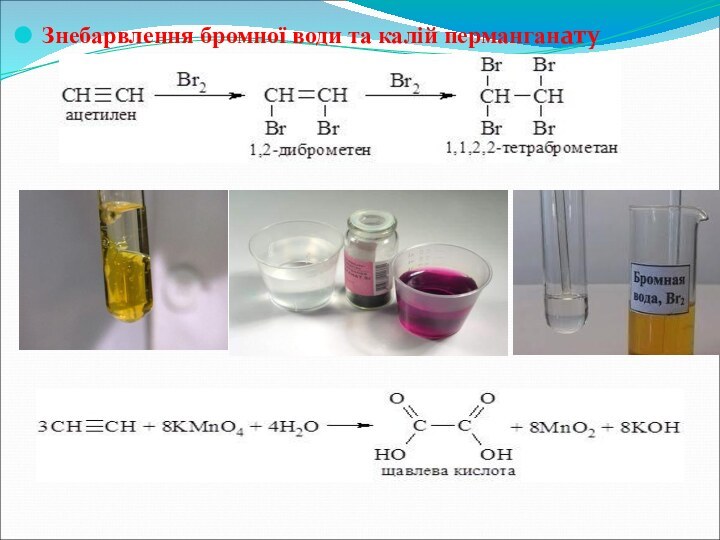
- 24. Знебарвлення бромної води та калій перманганату
- 25. 7.Вплив алкенів на організм людиниТривалі контакти працівників
- 26. 8.ЗастосуванняДобування: розчинників, ацетилену;паливо для дизельних та в металургії турбоактивних двигунів,фарб, ПВА
- 27. 9.Застосування в медициніАцетилен — один із базових сировинних
- 28. Полімерні сполуки на основі вінілпіролідону знайшли широке застосування
- 29. При співполімеризації вінілпіролідону, акриламіду та етилкрилату одержують біорозчинний полімер,
- 30. Ацетилен горить сильно кіптявим полум’ям тому, що
- 31. Скачать презентацию
- 32. Похожие презентации
ПланПлан:1.Алкіни. Визначення2.Будова алкінів3.Номенклатура та ізомерія4.Фізичні властивості5.Добування6.Хімічні властивості7. Вплив на організм людини8.Застосування9.Застосування в медицині10.Цікаві факти















Слайд 2
План
План:
1.Алкіни. Визначення
2.Будова алкінів
3.Номенклатура та ізомерія
4.Фізичні властивості
5.Добування
6.Хімічні властивості
7. Вплив
на організм людини
Слайд 3
1.Алкіни визначення
Алкіни(Ацетиленові)— це ненасичені вуглеводні, в молекулах яких
між вуглеводними атомами є один потрійний зв'язок.
Формула алкінів:
CnH2n-2 де n>2Ацителен
Слайд 4
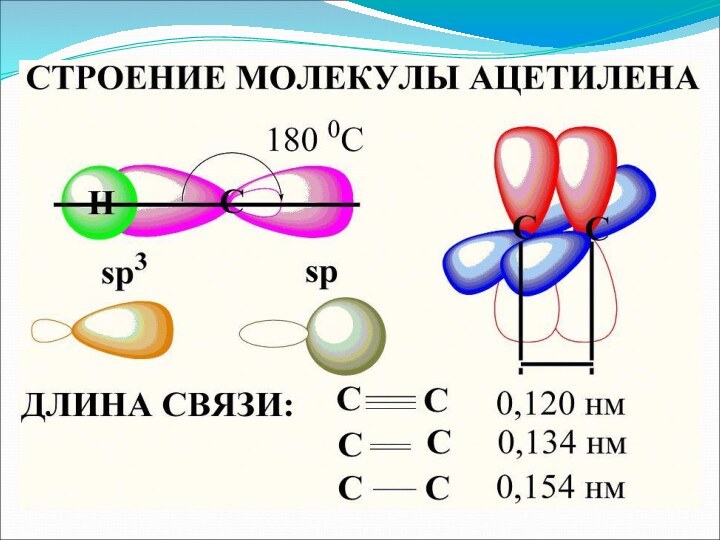
2.Будова алкінів
Першим і основним представником гомологічного ряду алкінів
є ацетилен або етін. Його молекулярна формула: C2H2.
Формула
ацетиленуСтруктурна електронна
Н—С≡С—Н Н:С:::С:Н
Слайд 5
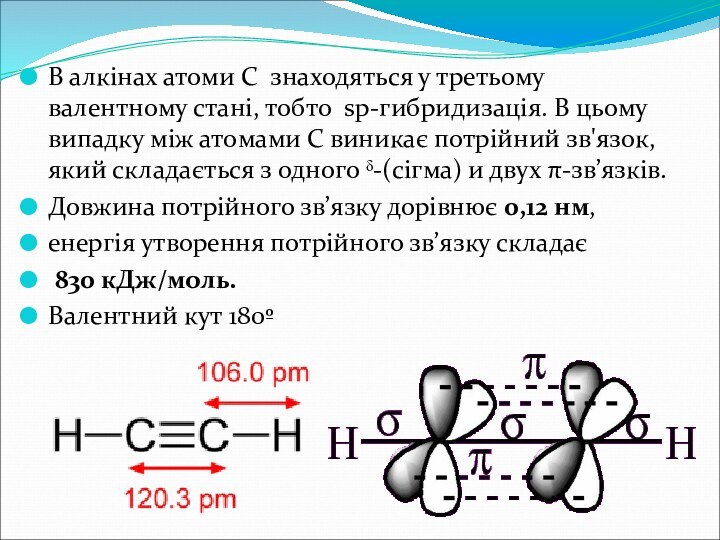
В алкінах атоми С знаходяться у третьому валентному
стані, тобто sp-гибридизація. В цьому випадку між атомами С
виникає потрійний зв'язок, який складається з одного ᵟ-(сігма) и двух π-зв’язків.Довжина потрійного зв’язку дорівнює 0,12 нм,
енергія утворення потрійного зв’язку складає
830 кДж/моль.
Валентний кут 180º
Слайд 7
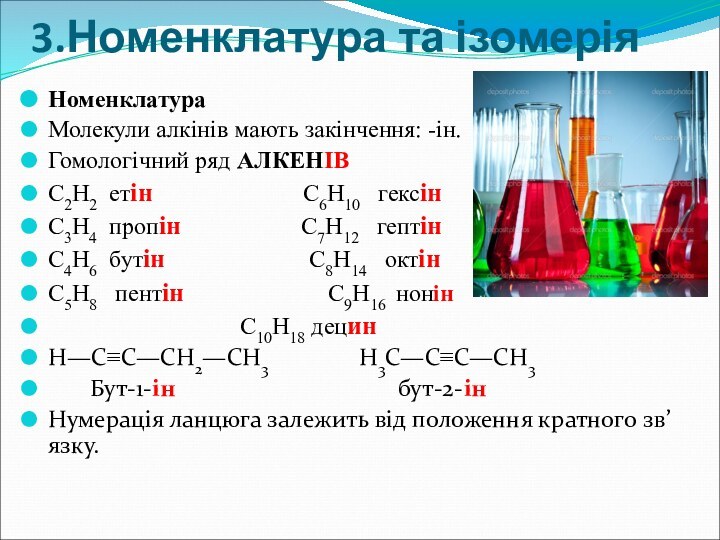
3.Номенклатура та ізомерія
Номенклатура
Молекули алкінів мають закінчення: -ін.
Гомологічний ряд
АЛКЕНІВ
C2H2 етін
C6H10 гексінC3H4 пропін C7H12 гептін
C4H6 бутін C8H14 октін
C5H8 пентін C9H16 нонін
C10H18 децин
Н—С≡С—СН2—СН3 Н3С—С≡С—СН3
Бут-1-ін бут-2-ін
Нумерація ланцюга залежить від положення кратного зв’язку.
Слайд 8
Ізомерія:
1)Міжкласова(Алкадієни)
СН3—СН2—СН2—СН2—С≡СН Гекс-1-ін
СН3—СН2—СН2=СН2—С=СН Гекс-1,3-ен
2)Структурна
2.1 По
положенню кратного зв’язку
С≡СН—СН2—СН2—СН3 Пент-1-ін
СН3—С≡С—СН2—СН3 Пент-2-ін
2.2 Вуглецевого скелету:
СН3—СН2—СН2—СН2—С≡СН; СН3—СН2—СН2—С≡СН
Гекс-1-ін 3-метилпент-1-ін
3-метилбут-1-ін
Слайд 9
4. Фізичні властивості
При звичайних умовах (С2-С4) — гази,
(С5-С16) — рідини, починаючи із С17 — тверді речовини. Температури
кипіння алкінів вищі, ніж у відповідних алкенів.Ацетилен
Газ без запаху, tплав.=-80,8ºС
Tкип.=-83,8ºС, слабко розчинний у воді, розчинний під тиском у ацетоні.
Слайд 10
5. Отримання алкінів
1. В промисловості:
1. Крекинг метана
2СН4 1500°C→
НС ≡ СН + 3Н2
Або етана:
С2Н6 1200°C→ НС
≡ СН + 2Н22.В лабораторії:
Дія вод на карбід кальція
СаО + 3C 2500°C→ CaC2 + CO
СаС2 + 2Н2O →НС ≡ СН + Са(ОН)2
3. Дія лугів на дигалагенопохідні
Н3С—СН—СН—СН3 + 2КОН → Н3С—С≡С—СН3 + 2KBr + 2Н2О
| |
Br Br
2,3-дибромбутан бутин-2
(диметилацетилен)
Слайд 12
6.Хімічні властивості
На повітрі ацетилен горить кіптявим полум’ям. Суміш
ацетилену з повітрям чи з киснем вибухонебезпечна.
Ацетилен є ненасиченою
сполукою, тому для нього характерні реакції приєднання. Реакції приєднання ацетилену проходять у дві стадії: спочатку потрійний зв’язок переходить у подвійний, а потім подвійний – в одинарний.
Слайд 14
1.2Галагенування
Алкін+2Наl2→тетрагалагеноалкан
Бромна вода—якісний реактив на потрійний зв'язок(обезбарвлює)
1.2Гідрогалагенування
Алкін+2ННаl2→дигалагеноалкан
Слайд 15
Правила Марковнікова:
Атом Н приєднується до більш гідрогенізованого атома,
а атом галогену до менш гідрогенізованого
Марковніков В.В. –російський хімік,
засновник наукової школи, досліджував взаємний вплив атомів в органічних сполуках і встановив ряд закономірностей (приєднання галогеноводнів до ненасичених вуглеводнів з подвійною і потрійною зв'язком)
Слайд 16
1.4 Гідратація( Р-ція Кучерова)
Ацетилен+НОН→Спирт(ненасичений)→Альдегід
(етаналь)
Алкін+НОН→ Спирт(ненасичений)→кетон
Каталізатори реакції Кучерова — зазвичай солі
ртуті (Hg2+). Реакція Кучерова лежить в основі промислового способу отримання
ацетальдегіду з ацетилену; відкрита російським хіміком Кучеровим у 1881 році
Слайд 17
КУЧЕРОВ Михайло Григорович
3 червня 1850 р. –
26 червня 1911 р.; російський хімік – органік,
Відкрив (1881) реакцію каталітичної гідратації ацетиленових вуглеводнів з утворенням карбонільних сполук, зокрема, перетворення ацетилену в ацетальдегід в присутності солей ртуті (реакція Кучерова). Показав (1909), що гідратацію ацетиленових вуглеводнів можна проводити в присутності солей магнію, цинку, кадмію
Слайд 18
Правило Ельтекова
Здатність ненасичених спирті ізомерезуватись до альдегідів та
кетонів.
У 1877 році А. Ельтеков на підставі своїх досліджень пріийшов до висновку про нестійкість ненасичених спиртів з гідроксильною групою при вуглецевому атомі , пов'язаному подвійним зв'язком. Пізніше, в 1880 це правило було сформульовано Ерленмейером.
Слайд 19
2.2 Взаємодія з окисниками
3.Реакції полімеризації
3.1 Димерізація
3.2Р-ція
тримерізація
Р-ція Зелінського
Умови: активоване
вугілля
Слайд 20
4.Р-ція заміщення
Алкіни, які мають ≡ на початку молекули
проявляють слабкі кислотні властивості.
Утворення ацетиленідів. Алкіни вступають у реакції
заміщення. Вони утворюють солі, які називаються ацетиленідами. Атом Гідрогену біля атома Карбону з потрійним зв’язком заміщується на метал: СН≡СН + 2NaNH2 → Na–C≡С–Na + 2NH3
натрій ацетиленід
СН≡СН + 2[Cu(NH3)2]OH → Cu–C≡С–Cu + 4NH3 +2H2O купрум ацетиленід
Слайд 21
5. Приєднання кислот
Для проведення реакції алкінів з кислотами
як каталізатори використовують солі меркурію (ІІ), купруму (І), кислоти
Льюіса тощоВзаємодією ацетилену з етановою кислотою синтезують вінілацетат або вініловий естер оцтової кислоти, який використовують для виробництва полівінілацетату (ПВА).
Слайд 22 Взаємодією ціанідної кислоти з ацетиленом синтезують інший важливий
продукт нітрил акрилової кислоти (акрилонітрил)
6. Утворення алкінгалогенідів
Ацетилен і його
термальні гомологи у лужному середовищі галогенуються гіпогалогенідамиCH3-C≡CH + Br2 + NaOH → CH3-C≡C–Br + NaBr + H2O
Слайд 23
7. Якісні реакції
Реакція алкінів з аміакатами аргентуму або
купруму (І) є якісною на наявність кінцевого потрійного зв'язку
CH3-C≡CH
+ [Ag(NH3)2]OH → CH3–C≡CAg + H2O + 2NH3CH3-C≡CH + [Ag(NH3)2]OH → CH3–C≡CAg + H2O + 2NH3
CH3-C≡C–CH3 + [Cu(NH3)2]OH → реакція не проходить
Аргентум пропінід осад білого кольору, купрум (І) пропінід - осад жовтого кольору, купрум (І) діацетіленід - осад червоного кольору.
Слайд 25
7.Вплив алкенів на організм людини
Тривалі контакти працівників із
ацетиленом у виробничних умовах викликають функціональні порушення нервової системи. Його
високі концентрації при незначному вмісті кисню призводять до втрати свідомості та набряку легень.
Слайд 26
8.Застосування
Добування: розчинників, ацетилену;паливо для дизельних та в металургії
турбоактивних двигунів,фарб, ПВА
Слайд 27
9.Застосування в медицині
Ацетилен — один із базових сировинних джерел
промисловості органічного синтезу. При конденсації ацетилену з піролідоном одержують N-вінілпіролідон, який
легко полімеризується з утворенням полівінілпіролідону (ПВП):Слайд 28 Полімерні сполуки на основі вінілпіролідону знайшли широке застосування в медичній
практиці як речовини при виробництві ЛП, а багато з них самі є
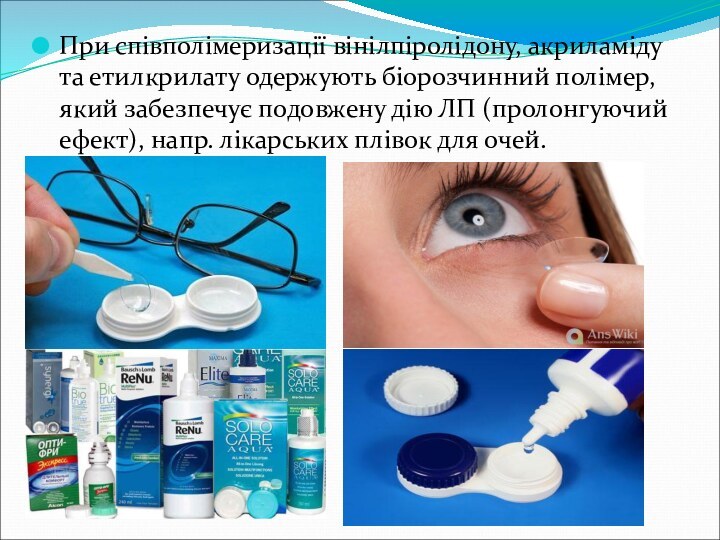
лікарськими. Напр. низькомолекулярний ПВП (12 000–13 000 мол. м.) утворює колоїдні розчини у воді й застосовується для приготування кровозамінника гемодезу, середньомолекулярний ПВП (35 000–40 000) використовується у фармації як зв’язуюча речовина для виробництва таблеток.Слайд 29 При співполімеризації вінілпіролідону, акриламіду та етилкрилату одержують біорозчинний полімер, який
забезпечує подовжену дію ЛП (пролонгуючий ефект), напр. лікарських плівок
для очей.Слайд 30 Ацетилен горить сильно кіптявим полум’ям тому, що містить
92% Карбону. При внесенні в полум’я ацетилену достатню кількість
повітря, полум’я світиться яскраво-білим світлом; температура полум’я досягає до 1900°С. В ацетилено-кисневому полум’ї температура досягає до 3000°С.Зелінський( відкрив реакцію тримерізації) у 1914р. Створив перший вугільний противогаз
Ацетилено-кисневе
пламя дає найбільш
високу температуру:
3100—3200 °С.
10.Цікаві факти