Слайд 2
СОДЕРЖАНИЕ:
1. Какие реакции называются окислительно-восстановительными?
2. Что называют окислителем,
восстановителем?
3. Окислительно-восстановительный потенциал. Стандартный потенциал
4. Дать понятие ЭДС. Уравнение
Нернста.
5. Факторы, влияющие на окислительно-восстановительные реакции
6. Перечислить основные окислители и основные восстановители
7.Применения реакции окисления-восстановления в анализе лекарственных веществ.
Слайд 3
Окислительно-восстановительные реакции - (реакции окисления-восстановления), химические
реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав
реагирующих веществ. Первоначально окислением назывались только реакции веществ с O2, а восстановлением — реакции, в результате которых вещество теряло атом кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций распространилось и на реакции без участия кислорода.
Окислитель, как отъявленный злодей,
Как пират, бандит, агрессор, Бармалей,
Отнимает электроны - и OK!
Потерпев урон, восстановитель
Восклицает: "Вот я! Помогите!
Электроны мне мои верните!"
Но никто ему не помогает
И тем более ущерб не возмещает.
Что такое ОВР?
Слайд 4
Окислением называется процесс отдачи атомом, молекулой или
ионом электронов. Степень окисления при этом повышается.
Восстановлением
называется процесс присоединения электронов атомом, молекулой или ионом. Степень окисления при этом понижается.
Слайд 5
В любой окислительно-восстановительной реакции участвуют не менее
двух редокс-пар не менее одного окислителя и одного восстановителя.
Возможность прохождения окислительно-восстановительной реакции определяется химической активностью редокс-пар, участвующих в ней.
Слайд 6
Химическую активность редокс-пары характеризуют величиной стандартного (нормального) окислительно-восстановительного
потенциала (редокс-потенциала) Е°.
Потенциал измеряют в электрохимической ячейке типа гальванического
элемента, состоящей из стандартного и индикаторного электрода, на котором проходит электрохимическая реакция восстановления или окисления компонента редокс-пары.
Измерение потенциала индикаторного (обычно платинового) электрода проводят относительно стандартного (нормального) водородного электрода.
Слайд 7
Стандартный (нормальный) окислительно-восстановительный потенциал Е° пар, содержащих электронейтральный
металл - разность потенциалов, возникающая между металлом, опущенным в
раствор своей соли (с активностью металл иона в 1 моль/дм3), и стандартным водородным электродом при 25°С.
Потенциал выражается в вольтах (В) и определяется опытным путем с помощью гальванических элементов.
Слайд 8
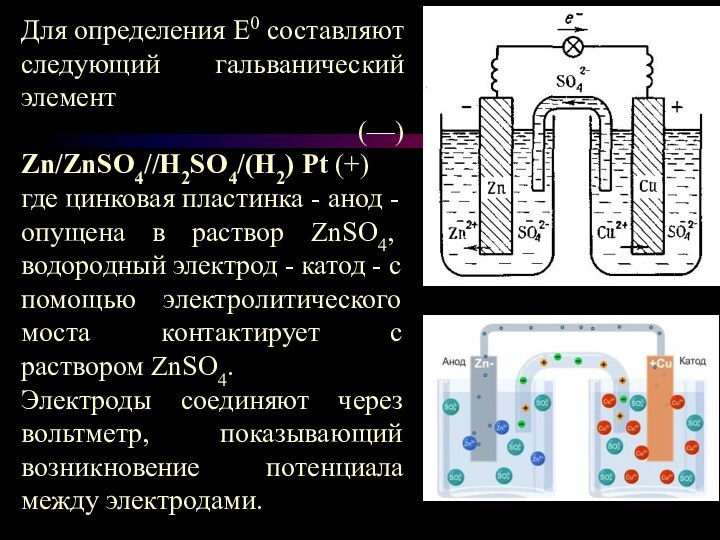
Для определения Е0 составляют следующий гальванический элемент
(—) Zn/ZnSO4//H2SO4/(H2) Pt (+)
где цинковая
пластинка - анод - опущена в раствор ZnSO4, водородный электрод - катод - с помощью электролитического моста контактирует с раствором ZnSO4.
Электроды соединяют через вольтметр, показывающий возникновение потенциала между электродами.
Слайд 9
При увеличении величины Е0 увеличивается сила
окислителя и соответственно уменьшается сила восстановителя.
Направление протекания реакций
Направление протекания реакции зависит от знака электродвижущей силы (ЭДС).
ЭДС= Еок-Ефвос
При ЭДС>0 протекает прямая реакция,
При ЭДС <0 обратная.
Слайд 10
Потенциал системы определяют по уравнению Нернста-Петерса:
E- Стандартный
редокс потенциал
R- Универсальная газовая постоянная
Т- абсолютная температура (Т=273+t
C)
F – постоянная Фарадея
n – число электронов, участвующих в процессах окисления или восстановления.
Подставив в уравнение значения F, R и преобразовав ln в lg, получим:
Слайд 11
Факторы, влияющие на окислительно-восстановительные реакции
На механизм окислительно-восстановительных реакций
оказывают влияние состояние окислителя и восстановителя, рН среды, растворитель,
температура, катализатор, наличие побочных реакций.
В зависимости от рН среды и состояния окислителей и восстановителей изменение степени окисления элемента на одну и ту же величину протекает при различных значениях потенциалов.
Слайд 12
Повышение щелочности среды (возрастание рН) снижает величину потенциала
(и окислительные свойства) окислителя и восстановителя, увеличивая его восстановительные
свойства.
Уменьшение значения рН (увеличение концентрации Н+ ионов) приводит, наоборот, к повышению значения Е°.
Слайд 13
Изменение рН среды приводит не только к изменению
величины потенциала, но и к образованию иных продуктов.
Сильное
влияние на окислительно-восстановительные реакции оказывает температура, повышение которой согласно уравнению увеличивает потенциал окислительно-восстановительной пары.
Это явление используют для ускорения протекания некоторых окислительно-восстановительных реакций.
Слайд 14
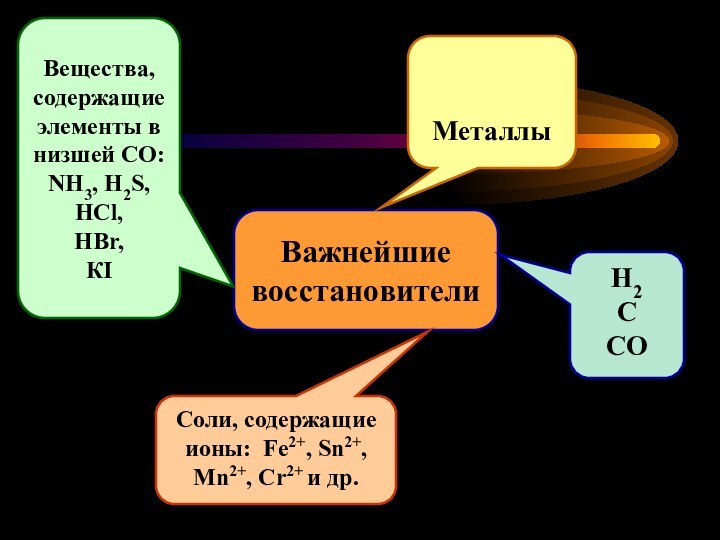
Важнейшие
восстановители
Металлы
Соли, содержащие ионы: Fe2+, Sn2+,
Mn2+, Cr2+ и др.
Вещества,
содержащие элементы в низшей СО:
NH3, H2S,
HCl,
HBr,
КI
H2
C
CO
Слайд 15
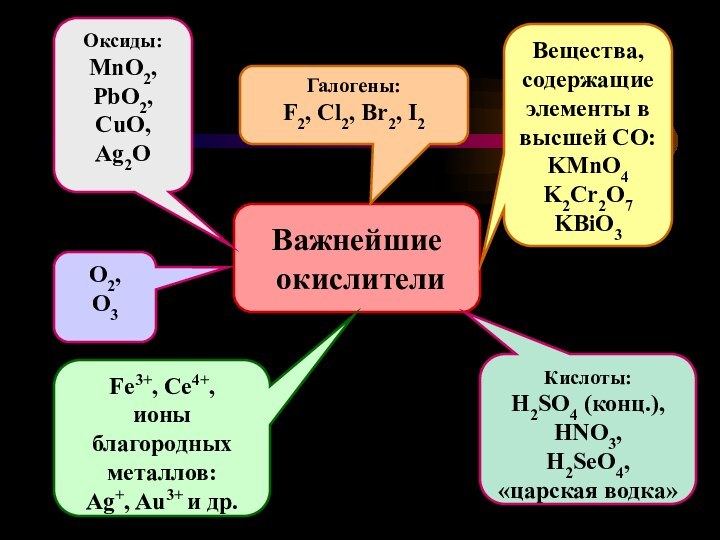
Важнейшие
окислители
Вещества, содержащие элементы в высшей СО:
KMnO4
K2Cr2O7
KBiO3
Галогены:
F2, Cl2,
Br2, I2
Оксиды:
MnO2,
PbO2,
CuO,
Ag2O
O2,
O3
Fe3+, Ce4+,
ионы
благородных
металлов:
Ag+, Au3+ и др.
Кислоты:
H2SO4 (конц.),
HNO3,
H2SeO4,
«царская водка»
Слайд 16
В качестве окислителей чаще в фармацевтических учреждениях применяются
титрованные растворы перманганата калия, бихромата калия, йода, йодата калия
и брамата калия.
С восстановителей применяются растворы тиосульфата натрия (для определения йода), сульфата железа (2 +), мышьяковистой кислоты, хлорида (2 +) и т.д. Отсюда отражают отдельные названия методик - йодометрия, броматометрия, перманганатометрия (манганометрия) и т.д.
Слайд 17
Методы окислительно-восстановительного титрования пригодны для определения многих органических
лекарственных веществ, которые являются потенциальными восстановителями, поэтому могут быть
окислены до веществ с целью восстановительной способностью, чем исходные вещества.
Конечную точку титрования в окислительно-восстановительных методах определяют с помощью редокс-индикаторов - веществ, способных в среде с определенным окислительно-восстановительным потенциалом окисляться и менять свою окраску, а также специфических индикаторов (например метиловый красный в броматометрии, крахмал в йодометрии ).